Владимир Ушаков - Радиационная безопасность. От теории к практике
- Название:Радиационная безопасность. От теории к практике
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785449004369
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Ушаков - Радиационная безопасность. От теории к практике краткое содержание
Радиационная безопасность. От теории к практике - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Это соотношение выражает закон взаимосвязи массы и энергии для любых тел, элементарных частиц и полей, подтверждая неразрывность движения и материи, оно подчеркивает общность всех видов энергии. Закон зависимости массы от скорости и закон взаимосвязи между массой и энергией получили экспериментальное подтверждение при ядерных реакциях, они имеют большое значение при расчетах ядерных процессов. Эти закономерности лежат в основе теории современной ядерной физики.
Так как с 2 является величиной постоянной, то всякое изменение энергии тела влечет за собой соответствующее изменение его массы, следовательно, количество энергии тела может оцениваться и величиной его массы. Поэтому не должно представляться странным выражение: «Солнце ежеминутно излучает энергию в количестве, равном 250х10 6 т».
Все тела с одинаковой массой содержат одинаковое количество энергии. Чтобы оценить энергию 1 г любого тела (металла, угля, песка и др.), надо в соотношение Эйнштейна поставить вместо m единицу, а вместо с – значение скорости света (3х10 10 см/с). Тогда, тело с массой 1 г обладает энергией, равной 9х10 20 эрг или 2,15х10 13 кал или 9х10 13 Дж, что соответствует количеству энергии, выделяющейся при сжигании около 3000 т каменного угля.
Из показанного примера следует, что природа располагает неисчислимыми запасами энергии, даже малой части которых достаточно для удовлетворения потребностей в энергии всего человечества. Однако в настоящее время освобождение и использование этой энергии является пока еще сложной проблемой.
Прежде чем приступить к рассмотрению вопросов, связанных с количественным выражением значений энергии, предлагается рассмотреть единицы измерения энергии и их количественные соотношения, вытекающие из эквивалентности различных физических форм энергии (табл. 1.1).
Таблица 1.1
Соотношения между энергетическими единицами
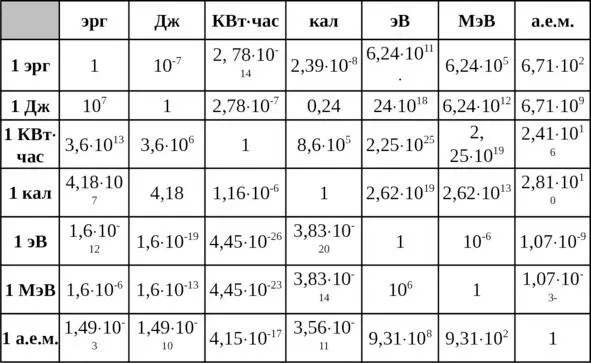
1кг массы вещества соответствует 5,61х10 22 МэВ или 0,603х10 24 а.е.м., а 1 а.е.м., в свою очередь, соответствует 1,66х10 —27 кг массы вещества.
В качестве единицы измерения энергии элементарных частиц в атомной физике применяют электрон-вольт (эВ). Один электрон-вольт (1 эВ) – это такое количество энергии, которое приобретает электрон при перемещении в постоянном электрическом поле с разностью потенциалов 1 В. При этом, электрическое поле совершает работу перемещения электрона, в результате чего энергия электрического поля преобразуется в кинетическую энергию электрона.
Ввиду того, что электрон-вольт представляет очень малую величину, энергию элементарных частиц измеряют в мегаэлектрон-вольтах (МэВ) (1 МэВ=10 6 эВ). Мегаэлектрон-вольт – малая величина энергии: 1 МэВ=1,6х10 13 Дж.
Электрон – стабильная элементарная частица, легчайшая из электрически заряженных материальных элементарных частиц. Электрон является также наименьшей частицей отрицательного электричества. Величина заряда электрона называется элементарным зарядом .
Важнейшими характеристиками элементарных частиц являются масса покоя (называемая также собственной массой) и электрический заряд . Масса покоя электрона m е =9,1095х10 —31 кг, отрицательный электрический заряд его (элементарный электрический заряд) равен 1,6х10 —19 Кл (кулон): 1 Кл – количество электричества, протекающего за 1 с через поперечное сечение проводника при силе тока 1 А.
Массы других частиц обычно выражают или в массах электрона, или в так называемых атомных единицах массы (а.е.м.).
За физическую атомную единицу массы принята 1/ 12 часть массы изотопа углерода 12С (1 а.е.м. = 1,66х10 —27 кг, т.е. в 1824 раза больше массы покоя электрона (1 а.е.м.=1824 m е )).
1.1.2. Строение вещества
В настоящее время известно около 1,5х10 6 типов молекул. Однако атомов к началу 1964 г. было идентифицировано 101, из них в природе встречаются 88, а 13 получаются искусственно. Все известные молекулы построены примерно из 60 типов атомов.
Множество атомов одного типа называется химическим элементом . Таким образом, эти элементы являются теми «кирпичами», из которых сложены в многообразных комбинациях все тела окружающего нас материального мира – неорганического, органического, растительного и животного.
Атом является мельчайшей первичной частицей химического элемента. Он представляет собой сложную электродинамическую систему, состоящую из двух частей: небольшой очень плотной положительно заряженной центральной части, именуемой ядром, и легкой внешней (орбитальной) электронной оболочки, образованной отрицательно заряженными элементарными частицами – электронами. Атомные ядра представляют собой сложные образования, состоящие из элементарных материальных частиц – протонов с положительным электрическим зарядом и нейтронов , которые электрического заряда не имеют. Протоны и нейтроны носят общее название – нуклоны.
Ядро атома водорода (наиболее легкого из всех элементов) состоит из одного протона и не содержит нейтронов.
Протон – стабильная элементарная частица, обладающая положительным зарядом (ядро атома водорода). Масса протона в 1837 раз больше массы электрона (т. е. составляет 1837 m е или 1,00758 а.е.м.). Заряд протона равен по абсолютной величине заряду электрона, но противоположен ему по знаку, т. е. равен одной положительной элементарной единице заряда. Протон обозначается 1 1р, где индексы обозначают массу и заряд протона.
Нейтрон – это нейтральная частица. Масса нейтрона равна 1839 m е или 1,00893 а.е.м., то есть примерно равна массе протона. В свободном состоянии нейтрон – неустойчивая частица и претерпевает превращения. Нейтрон обозначается 1 0n, где индекс 0 – заряд нейтрона, индекс 1 – масса нейтрона.
Таким образом, почти вся масса атома сосредоточивается в его ядре; масса электронной оболочки составляет сотые доли процента массы атома (см. табл. 1.2).
Таблица 1.2
Значения масс покоя и электрических зарядов элементарных частиц атома
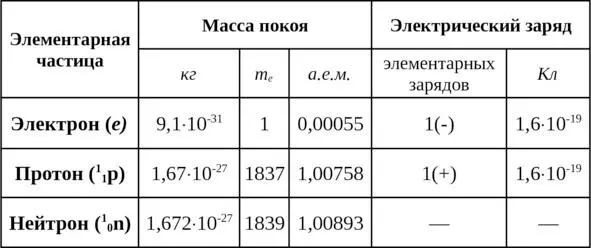
При нормальном (невозбужденном) состоянии атома число электронов его оболочки равно числу протонов ядра, следовательно, атом электрически нейтрален. Отношение числа нейтронов к числу протонов в ядрах атомов (кроме ядра атома водорода) равняется приблизительно единице для легких ядер и постепенно возрастает до 1,6 с увеличением массы ядра.
В современной физике принято считать, что атомы имеют строение, напоминающее (геометрически) планетную систему Солнца. В центре электродинамической системы атома находится ядро, вокруг которого движутся по своим орбитам электроны. Геометрическая модель атома представлена на рис. 1.1.
Читать дальшеИнтервал:
Закладка:










