Владимир Ушаков - Радиационная безопасность. От теории к практике
- Название:Радиационная безопасность. От теории к практике
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785449004369
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Ушаков - Радиационная безопасность. От теории к практике краткое содержание
Радиационная безопасность. От теории к практике - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Число положительных зарядов атомного ядра (число протонов) называется атомным номером Z элемента.
Число нуклонов (протонов и нейтронов) в ядре называют массовым числом А элемента A = N + Z ,
где N – число нейтронов в ядре ( N = А – Z ).
Заряд ядра обусловлен наличием в нем протонов. Заряд любого ядра равен Q = Ze ,
где е – заряд протона, Кл.
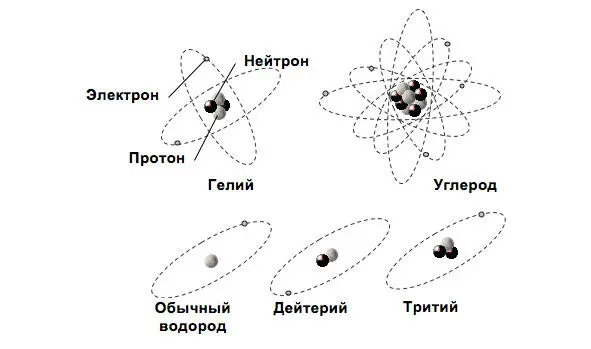
Рис. 1.1. Планетарная модель атома
По величине заряда ядра все химические элементы располагаются в определенной последовательности в соответствии с периодической таблицей элементов Менделеева. Порядковый номер элемента в этой таблице равен заряду его ядра.
Вид атомов с данными числами протонов и нейтронов в ядре называют нуклидоми обозначают символом элемента с указанием атомного номера (внизу слева) и массового числа (вверху слева), например, 4 2He – гелий с зарядом, равным двум зарядам электрона, и массовым числом, равным 4 (см. рис. 1.1).
Массовое число равно ближайшему целому числу, выражающему атомный вес элемента. Например, записи, характеризующие изотопы урана: 238 92U, 235 92U и 233 92U, означают, что все эти изотопы имеют один атомный номер 92, числа же нейтронов их атомных ядер различны и соответственно равны: 238—92=146; 235—92=143 и 233—92=141.
Количество электронов в атоме равно количеству протонов в его ядре (см. рис.1.1). Электроны в атоме сгруппированы по электронным оболочкам (орбитам), номера которых возрастают по мере удаления от ядра: n =1,2,3,4… Суммарный отрицательный заряд всех орбитальных электронов равен суммарному положительному заряду протонов ядра. Атом в нормальном состоянии – электрически нейтральная система .
Энергия связи, благодаря которой электроны удерживаются в атоме, зависит от расстояния электрона до центра атома. Каждая орбита соответствует вполне определенному значению этой энергии.
Электроны, расположенные вблизи ядра, находятся под действием большей силы притяжения, чем электроны, находящиеся дальше от него. Когда электрон, оставаясь внутри атома, переходит с одной орбиты на другую, то выделяется или поглощается энергия. Электрон, переходя с ближней обриты на более удаленную от ядра, должен преодолеть силу притяжения ядра, т.е. приобрести (поглотить) дополнительную энергию. При переходе электрона с дальней орбиты на ближайшую к ядру происходит выделение энергии, которая может быть излучена атомом.
Атом, в котором электроны обращаются на более удаленной от ядра орбите, чем им дозволенной, называется возбужденным. Возбужденный атом неустойчив и время его жизни в этом состоянии: х 10 —8 с.
Из периодической системы элементов видно, что атомы различных элементов имеют различное количество слоев (орбит) электронов. Оно зависит от атомного номера, который определяет положение (период) элементов в периодической системе. Наибольшее число слоев электронной оболочки равно семи.
Исходя из того, что атом представляет собой электродинамическую систему планетарной структуры, под диаметром атома понимают диаметр воображаемой сферы, заключающей в себе атом, внутрь которой не может проникнуть другой атом из-за действия сил отталкивания, возникающих между электронными оболочками (см. рис. 1.1). Диаметр атома около 10 —8 см. Размеры атомных ядер очень малы; плотность же ядерного вещества чрезвычайно большая.
Диаметр ядра атомов различных элементов лежит в пределах 10 —13 – 10 —12 см, т. е. в 10 4 – 10 5 раз меньше диаметра атома. Радиус атомного ядра может быть определен по формуле R = 1,5 x 10 —13xA 1/3, где А – число нуклонов в ядре (массовое число).
Радиус атома приблизительно равен (2,5…5,5) х10 —11м, а радиус атомного ядра (1,5—10) х10 —16м. Так, радиус ядра атома 238 92U составляет приблизительно 0,93х10 —15м, а его объем —3,4х10 —40м 3.
Исходя из того, что масса каждого нуклона равна приблизительно 1 а.е.м. или 1,66х10 —27кг, масса ядра урана равна приблизительно 395х10 —27кг. Плотность ядерного вещества урана равна 116 000 кг/м 3. Плотность ядерного вещества других элементов примерно такая же.
Из изложенного следует, что основная часть энергии атома сосредоточена в его ядре, на электронную же оболочку остается сравнительно ничтожная ее доля. Поэтому перспективным путем получения больших количеств промышленной энергии является деление атомных ядер, в результате которого выделяется ядерная энергия.
1.1.3. Изотопы. Радиоактивность и ее закономерности
Существует много атомов, ядра которых содержат равное число протонов, но разное число нейтронов. Массовые числа у этих атомов различны, но их химические свойства одинаковы, так как они имеют один и тот же заряд ядра и, следовательно, занимают одно и то же место в таблице Менделеева. Такие атомы получили название изотопов . Изотоп – нуклид с числом протонов в ядре, свойственным данному элементу.
Изотопный состав имеют многие химические элементы, некоторые из них имеют относительно большое количество изотопов. Например, водород имеет три изотопа: 1 1H – протий (легчайший изотоп водорода), 1 2D – дейтерий, 1 3T – тритий; известны: 19 изотопов йода, восемь изотопов железа, шесть изотопов урана и т. д.
Изотопы одного элемента химическими методами не могут быть разделены. Записываются изотопы элементов одинаковыми символами, отличающимися один от другого лишь массовым числом, например: изотоп углерода – от 10 6C до 14 6C; изотоп алюминия – от 26 13Al до 29 13Al; изотоп урана – от 233 92U до 239 92U и т. д.
Известно около 1500 изотопов. Одни из них устойчивые – стабильные , другие неустойчивые – радиоактивные . Стабильные изотопы – изотопы, ядра которых в течение длительного промежутка времени не претерпевают изменения. Изотопы, ядра которых со временем распадаются, называют радиоактивными или радионуклидами (РН). Радионуклид – нуклид, обладающий радиоактивностью. Радиоизотоп – изотоп, обладающий радиоактивностью.
В конце XIX в. А. Беккерелем, Пьером и Марией Кюри и другими учеными было открыто явление самопроизвольного распада ядер некоторых неустойчивых химических элементов. Исследователи установили, что распадающиеся ядра претерпевают превращения с образованием новых изотопов элемента и даже новых элементов, при этом выделяется энергия в виде радиоактивных излучений.
Радиоактивность – самопроизвольное превращение неустойчивого нуклида в другой нуклид, сопровождающееся испусканием ионизирующего излучения. Явление самопроизвольного распада ядер называется естественной радиоактивностью, а неустойчивые изотопы, претерпевающие самопроизвольные превращения, радиоактивными. Специально приготовленные радиоактивные изотопы называют искусственно радиоактивными.
Читать дальшеИнтервал:
Закладка:










