Г. Самбурский - Технологические и организационные аспекты процессов получения воды питьевого качества
- Название:Технологические и организационные аспекты процессов получения воды питьевого качества
- Автор:
- Жанр:
- Издательство:Литагент Ридеро
- Год:неизвестен
- ISBN:9785448353697
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Г. Самбурский - Технологические и организационные аспекты процессов получения воды питьевого качества краткое содержание
Технологические и организационные аспекты процессов получения воды питьевого качества - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Группа показателей – химические
К группе химических показателей, характеризующих загрязнение воды и водоисточников, относят в качестве так называемых обобщенных показателей водородный показатель рН, общая минерализация (сухой остаток), жесткость, щелочность, окисляемость, а также показатели значения концентрации растворенных форм органических и неорганических веществ, нефтепродуктов, поверхностно-активных веществ (ПАВ) и пр. (табл. 4).
Содержание минеральных солей оценивают по концентрации различных катионов и анионов, в зависимости от задач анализа.
Взвешенные частицы, в т.ч. химические соединения, не растворимые в воде, влияют на прозрачность воды; оценка их содержания позволяет оценить степень загрязненности воды частицами с условным диаметром более 1·10 —4 мм (10 3 Å).
Взвешенные твердые примеси, присутствующие в природных водах, состоят из частиц глины, песка, ила, органических и неорганических веществ и различных микроорганизмов. При содержании в воде взвешенных веществ ниже 2—3 мг/л или с условным диаметром частиц меньше 1·10 —4 мм, определение загрязненности воды производят косвенно по мутности. Мутность воды, как было отмечено выше, вызвана тонкодисперсными примесями. Она обусловлена нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения.
Прямое определение органических примесей в воде затруднено, поэтому их содержание оценивается косвенным методом – по окисляемости (мг О/л). В качестве окислителя чаще всего применяют перманганат калия (KMnO 4). Более сложным является альтернативное непрямое определение органических примесей – общее содержание углерода, ТОС (Total Organic Carbon).
С конца 1990-х годов серьезное внимание уделяется опасности попадания в питьевую воду крупных городов стероидов и фармацевтических веществ (см. напр., [119,120]).
Данные по токсикологии металлов, в частности, новые результаты по изучению канцерогенных свойств соединений хрома, приведены в [120—130]. Анализ воздействия на человеческий организм и методов контроля содержания фторид-ионов в питьевой воде – в [122,123]. В обзорах [131—140] приведено описание новых методов анализа воды и методик определения содержания в ней загрязняющих веществ. Методы масс-спектрометрии дают возможность определить присутствие органических соединений на уровне следовых концентраций [133 – 139].
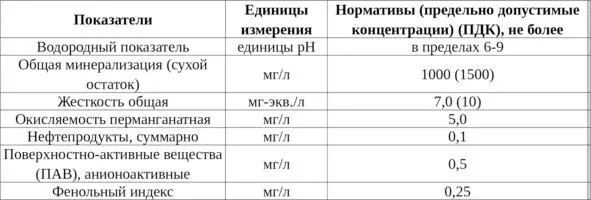
Таблица 4. Группа показателей – химические
рН – водородный показатель
Определение рН или водородного показателя воды – это вычисление значений показателя концентрации ионов гидроксония (водородных катионов), который математически равен отрицательному логарифму значения концентрации водородных ионов:
рН = -1g (Н +)
Молекулу воды относится к так называемым слабым электролитам. Степень ее собственной диссоциации на ионы (ион водорода Н + и гидроксильный ион ОН -) очень невелика. Произведение концентраций этих ионов называется ионным произведением воды Кw:
Kw = (H +) (OH -) = (10 —7) (10 —7) = 10 —14 (моль/л) 2
Так, оценивают, что из 10 млн. молекул воды только одна диссоциирует на ион водорода и гидроксильный ион:
Н 2О – ›Н + + ОН -
Деминерализованная чистая вода должна в идеале иметь значение рН ≈ 7.
Присутствие солей, содержащих катионы и анионы слабых кислот и оснований, оказывает сильное влияние на значение водородного показателя:
Mg 2+∙H 2O + H 2O ↔ MgOH + + H 3O +
CO 3 2- + H 2O ↔ HCO 3 - + OH - и т. д.
Таким образом, рН воды всегда определяется соотношением концентраций ионов, которые участвуют в кислотно-основном равновесии для данной пробы воды. Если концентрация образующихся гидроксильных ионов выше, чем концентрация ионов водорода, то показатель рН имеет значение больше 7 и среда характеризуется, как щелочная. Если выше концентрация ионов водорода (ионов гидроксония), то pH меньше 7 и среда характеризуется, как кислая. Общие требования к качеству воды приведены в гигиенических нормативах [37,38].
Соответственно, активная реакция воды в зависимости от концентрации водородных ионов может быть нейтральной, кислой или щелочной (табл. 5).
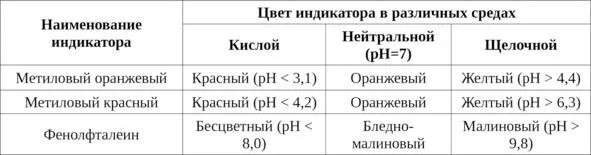
Таблица 5. Определение рН индикаторным способом
Показатель – общая минерализация
Показатель общей минерализации характеризует суммарную концентрация всех ионов (анионов, катионов) и недиссоциированных соединений, а также растворенных в воде органических веществ, которая имеет единицы измерения грамм на литр (г/л) или на кубический дециметр (г/дм 3).
Фактически, общая минерализация при определении в воде может быть по значению близка с показателем «сухой остаток», который анализируют посредством выпаривания пробы воды определенного объема, которую предварительно профильтровывают через бумажный фильтр, а далее высушивают при температуре 105—120 °С до постоянного веса. Следует учесть, что сухой осадок не учитывает фракцию отогнанных при выпаривании органических соединений. Сухой остаток можно рассчитать также путем суммирования приведенных значений концентраций анионов и катионов, определенных различными методами химического анализа. По действующим нормативам общая минерализация питьевой воды не должна превышать 1 г/л. [37,38,43, 44—46]
Показатель – жесткость воды
Наличие жесткости воды обусловлено присутствием в любой воде катионов некоторых металлов, в том числе: кальция (Са 2+), магния (Mg 2+), стронция (Sr 2+), бария (Ва 2+), железа (Fe 2+, Fe 3+), марганца (Mn 2+) и некоторых других.
Вследствие того факта, что показатели значения концентрации ионов кальция и магния для воды естественного происхождения практически во всех случаях выше, чем для ионов других металлов, общее значение показателя жесткости определяют, основываясь на анализе концентраций именно катионов кальция и магния. В целом, значение общей жесткости определяется приведенным сложением значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. В свою очередь, постоянная жесткость вызывается присутствием в воде кальция и магния в виде сульфатов, хлоридов, силикатов, фосфатов.
Жесткость воды, вызванная наличием катионов кальция и магния, связана с процессами образования с присутствующими в воде карбонатными и гидроксильными ионами малорастворимых соединений кальция и магния. Имеющиеся в природных водах гидрокарбонатные анионы при повышении температуры разлагаются на углекислый газ и ион угольной кислоты:
Читать дальшеИнтервал:
Закладка:










