Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
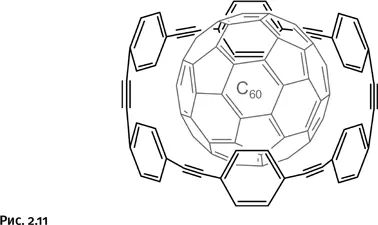
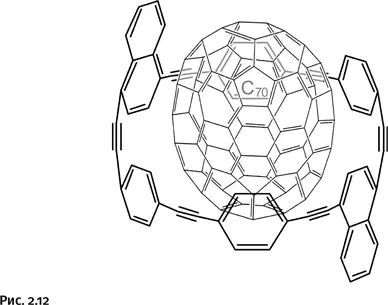
Если часть бензольных циклов в ленте заменить нафталиновыми, то полученная лента хорошо удерживает более крупный фуллерен С 70(рис. 2.12).
Итак, получились комплексы совершенно нового типа, которые к тому же позволяют разделить фуллерены разного размера.
Фантазия химиков на этом не иссякла, и они решили собрать ленту без ацетилена – только из молекул бензола, что на первый взгляд казалось недостижимым. Стратегия была та же: сначала сделать кольцо из того, что можно согнуть, а затем превратить полученное соединение в то, что нужно.
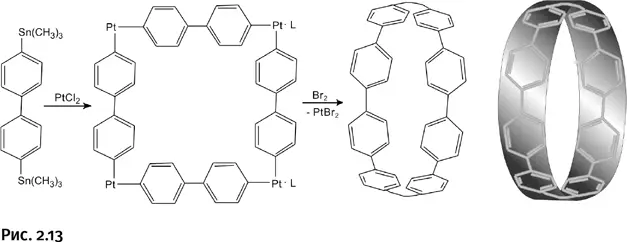
Исходным соединением стал дифенил (содержит два бензольных цикла), у которого два заместителя – Sn(CH 3) 3. Из этого соединения получили цикл, содержащий восемь бензольных ядер и четыре атома платины. Соединение обработали бромом Br 2, который «забрал» атомы платины Pt, в результате образовалась лента из одних бензольных циклов (рис. 2.13).
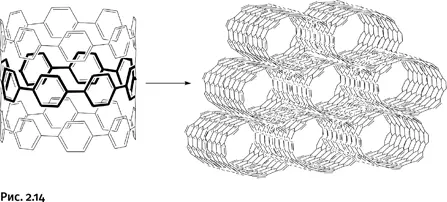
При кристаллизации такого соединения ленты укладываются в цилиндры, которые затем упаковываются в параллельно расположенные трубы (рис. 2.14).
Обычные углеродные нанотрубки получают высокотемпературным испарением графита, они содержат только атомы углерода, а в полученных трубчатых конструкциях есть фрагменты С – Н, т. е. это не углеродные, а углеводородные трубки. Фактически это совершенно новая форма нанотрубок, полученных с помощью органического синтеза. В таких соединениях можно менять состав исходных ленточных заготовок и тем самым направленно изменять свойства всей трубчатой конструкции.
Расплющить углеродную пирамидку
Чрезмерная теснота
не только сближает,
но и плющит.
ЮРИЙ ТАТАРКИНЕсли атом углерода имеет четыре заместителя, то его химические связи направлены к вершинам мысленного тетраэдра (четырехгранная пирамида), причем сам он находится в центре этой пирамиды. Все углы Н – С – Н одинаковы – 109°28’. На рисунке 2.15 изображены молекулы метана CH 4и этана С 2Н 6, ребра тетраэдров показаны пунктирными линиями. Это именно то, что называют тетраэдрическим углеродом.
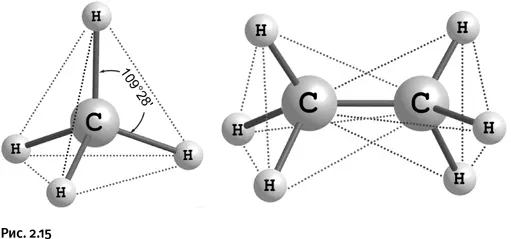
Заместители у атома углерода могут быть различными, не только Н, но и, например, галогены или другие группы, тетраэдрическая конструкция при этом сохраняется. С того момента, когда первый лауреат Нобелевской премии по химии за 1901 г. Я. Вант-Гофф (рис. 2.16) предложил конструкцию тетраэдра, где четырехзамещенный углерод находится в центре мысленной пирамиды, этот факт оставался непреложной истиной. Исследования второй половины ХХ в. показали, что небольшие отклонения от тетраэдра можно наблюдать в тех случаях, когда атом углерода входит в состав напряженных трех- или четырехчленных циклов. Постепенно химиков стала привлекать идея – расплющить такой тетраэдр и получить соединение, у которого все четыре связи атома С лежат в одной плоскости. Современная химия достигла такого уровня, когда исследователи не только изучают закономерности природы, но и пытаются их преодолеть, иными словами, стараются научиться «управлять» веществом.

Вставим атом в оконный переплет
Если в некоторых циклах происходит небольшая деформация тетраэдра, то надо поместить атом углерода внутрь такого цикла, в котором у него не останется иного выбора, как стать «плоским». Так созрела идея получить конструкцию, напоминающую оконный переплет, где в центре находится плоская крестовина. Эти предполагаемые соединения назвали фенестранами (от лат. fenestre – окно).
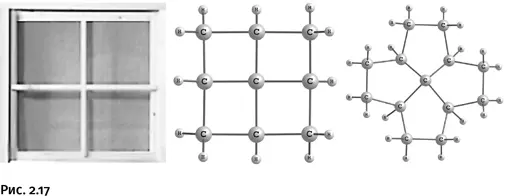
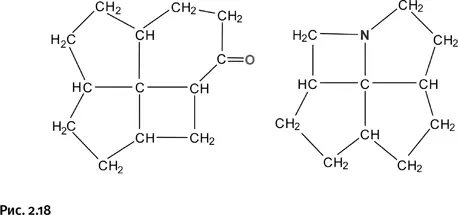
Соединения, показанные на рисунке 2.17, получить не удалось, однако близкие к ним по строению молекулы, содержащие узел «оконного переплета», были синтезированы (рис. 2.18).
Это результаты сложного многостадийного синтеза; полученные молекулы оказались напряженными и потому весьма нестабильными, к тому же валентности центрального атома углерода не располагались в одной плоскости. Таким образом, чисто геометрический подход, основанный на формировании определенной жесткой конструкции, к успеху не привел. Решение следовало искать иным путем.
Плоский углерод существует, но…
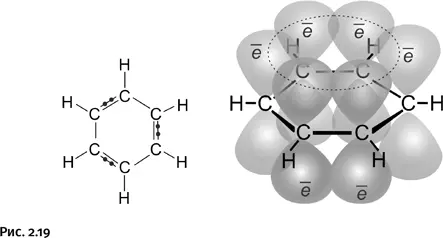
Примеров, когда валентности углерода лежат в одной плоскости, много, но это не четырехзамещенный атом, а трехзамещенный. Атом углерода имеет «плоское» окружение в молекулах этилена и бензола, именно на последнем упомянутом соединении и сосредоточим внимание. В бензоле все атомы, в том числе и атомы водорода, расположены в одной плоскости, это результат сочетания двух условий: необходимо, во-первых, взаимоперекрывание соседних орбиталей в циклической молекуле и, во-вторых, участие «нужного» количества электронов (в случае бензола их шесть). Напомним, что орбиталь – это область наиболее вероятного расположения электрона в пространстве. Одинарные связи бензола рассматривать не будем, сосредоточим внимание на двойных, которые образуются с участием р -электронов, их орбитали имеют форму объемных восьмерок. Электрон на такой орбитали «осваивает» весь объем, располагаясь как в «верхней», так и в «нижней» части восьмерки. Эти орбитали перекрываются, простые и двойные связи усредняются и становятся одинаковыми, молекула приобретает дополнительную устойчивость – такие соединения называют ароматическими (рис. 2.19).
Существуют ароматические циклы и с меньшим количеством атомов: например, циклопентадиенил-анион (анион, полученный из циклопентадиена С 5Н 6). У него пять атомов в цикле, но главное, что молекула циклическая и участвуют в перекрывании тоже шесть электронов. Одна из точек в центре структуры на рис. 2.20 – это электрон, который оставил атому С ушедший протон Н +. Поэтому вся молекула приобрела отрицательный заряд, т. е. стала анионом, но поскольку соблюдены два упомянутых условия, то соединение тоже ароматическое. У ароматических соединений и сами циклы, и отходящие от них связи всегда лежат в одной плоскости.
Читать дальшеИнтервал:
Закладка:









