Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Количество электронов, необходимое для образования циклической ароматической системы, определяется правилом Хюккеля: необходимо участие 4 n + 2 электронов, где n – число натурального ряда (0, 1, 2, 3 и т. д.). Но если n = 0, то получается, что для образования ароматического цикла достаточно всего двух электронов. Такая молекула существует, это циклопропенил-катион. Если от хлорзамещенного циклопропена отщепить анион Cl –(например, действием SbCl 5), то образуется нужный циклический катион, содержащий всего два р -электрона (те, которые образуют двойную связь).
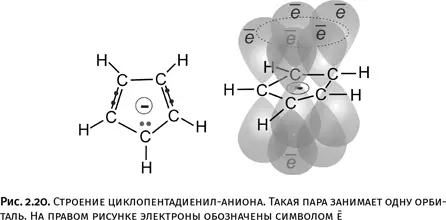
В циклопропенил-катионе имеются две р -орбитали, каждая содержит по одному электрону, и еще освободившаяся пустая орбиталь у «нижнего» углерода, от которого Cl –унес электрон. Три орбитали циклической молекулы перекрываются, и главное, что на них два электрона, т. е. именно столько, сколько требует правило Хюккеля. Трехчленный цикл становится ароматическим, все связи усредняются, молекула стабилизируется, а заряд (+) располагается не на конкретном атоме, а равномерно распределяется по всей молекуле (рис. 2.21).
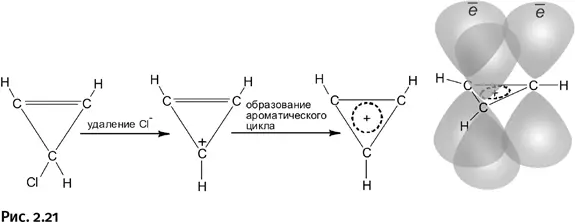
Вновь получился плоский углерод, но не четырехзамещенный, а трехзамещенный: это означает, что у каждого атома С три соседа – два атома углерода и один атом водорода.
Этот катион и навел химиков на мысль, что можно получить ароматический трехчленный цикл, заменив два из трех атомов углерода другими элементами, которые вполне могут быть и не связаны между собой простой химической связью (ароматичность их потом объединит в цикл). В таком случае надо брать элементы, которые образуют только одну химическую связь, т. е. щелочные металлы. Перечисленным условиям удовлетворяет дилитийметан H 2CL3.
Именно такое соединение выбрал в 70-е гг. ХХ в. Пол фон Шлейер (Университет Джорджии, США) для теоретических расчетов. В результате он выяснил, что предполагаемый линейный вариант строения молекулы Li-CH 2-Li менее энергетически выгоден, нежели угловой, т. е. треугольная форма предпочтительнее (рис. 2.22).
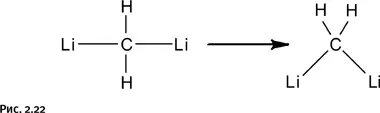
Если это треугольник, то, следовательно, возможно образование ароматического цикла, только, в отличие от рассмотренного циклопропенил-катиона, это не ион, а нейтральная молекула. Впрочем, это не так существенно, важно лишь, чтобы три перекрывающиеся р -орбитали содержали нужное количество электронов, т. е. два. Дилитийметан этим условиям полностью удовлетворяет: каждый из двух атомов лития, образуя связь, отдает по одному электрону атому углерода, в результате р -орбитали атомов лития становятся пустыми, а р -орбиталь атома углерода с двумя полученными электронами перекрывается с этими пустыми (вакантными) орбиталями двух атомов лития и возникает циклическая ароматическая система. Ранее было сказано, что все атомы ароматических циклов и отходящие от них связи всегда лежат в одной плоскости, следовательно, атомы Н и атомы Li, связанные с углеродом (т. е. все четыре валентных штриха), тоже должны лежать в одной плоскости (рис. 2.23).
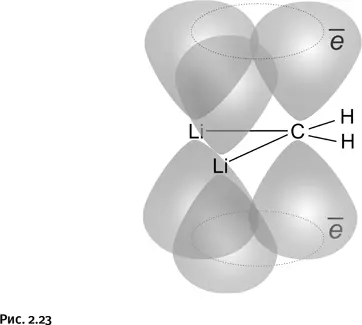
Таким образом, в дилитийметане находится долгожданный плоский углерод.
Напомним, что это итоги теоретических расчетов, которые желательно было подтвердить экспериментально. Химики, естественно, сразу обратили внимание на это соединение, после чего дилитийметан был получен по простой схеме (рис. 2.24).
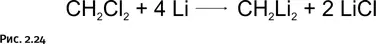
Однако синтезированное соединение образовывало агрегаты из многих молекул [CH 2Li 2] n, и получить какие-либо экспериментальные подтверждения его структуры не удалось. Тем не менее современные химики уже не сомневаются, что все связи атома С в этом соединении лежат в одной плоскости.
Важная примета современной химии – теоретические расчеты – указали химикам-синтетикам направление поисков.

Очень хочется увидеть плоский углерод
Увидеть молекулу позволяет рентгеноструктурный анализ, но для этого требуется одиночный кристалл без дефектов. Таким образом, требовалось чем-то «укрыть» молекулы дилитийметана (чтобы они не образовывали агрегаты) в надежде получить устойчивое соединение, пригодное для рентгеноструктурного анализа. Такую попытку сделал в 2010 г. профессор Ноттингемского университета в Англии Стефан Лиддл (рис. 2.25). Он решил заменить атомы водорода в дилитийметане объемными группами, которые заодно должны заблокировать атомы лития. И в результате получил соединение, в котором к атому углерода присоединены две фосфорорганические группы, а атомы лития укрыты объемными координирующими молекулами – лигандами (рис. 2.26).
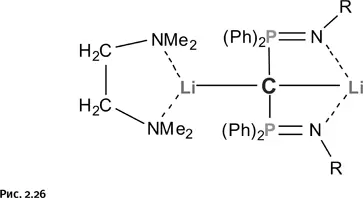
Полученное соединение удалось кристаллизовать, и рентгеноструктурный анализ позволил увидеть его строение. Оказалось, что атомы Li и Р, чередуясь, расположились в вершинах мысленного квадрата. Осталось решить самый главный вопрос: лежат ли все пять атомов (один С, два Li и два Р) в одной плоскости? Рентгеноструктурный анализ дал однозначный ответ. На рисунке 2.27 показано истинное расположение атомов.
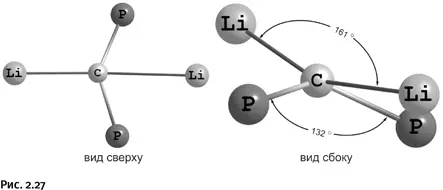
Угол Li-C–Li равен 161°, угол Р-С-Р – 132°. Если бы молекула была плоской, то оба угла были бы 180°. Таким образом, получен «не совсем плоский» углерод. Тем не менее при сравнении этой структуры со структурой метана (см. рис. 2.15), в котором все углы 109°, нельзя не оценить достижение Лиддла, сумевшего так мощно сплющить углеродную пирамидку.
Возникает вопрос: можно ли все же получить абсолютно плоский углерод? Есть все основания полагать, что дилитийметан H 2CLi 2, скорее всего, абсолютно плоский, причем сплющиванию дополнительно помогает ароматичность трехчленного цикла (молекула Лиддла все же заметно отличается от H 2CLi 2по составу). Вполне возможно, что вскоре кому-то удастся предложить свой способ, который позволит аккуратно стабилизировать отдельные молекулы дилитийметана (так, чтобы он не образовывал агрегаты) и затем надежно доказать его структуру.
Читать дальшеИнтервал:
Закладка:









