Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
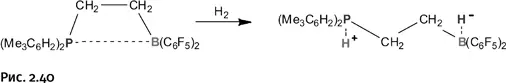
Некоторые исследователи при составлении таких пар в качестве борорганического соединения использовали многократно проверенный Стефаном B(C 6F 5) 3, однако в качестве акцептора помимо бора успешно может работать алюминий, окруженный, естественно, объемными группами, оттягивающими к тому же электроны, – Al(C 6F 5) 3.
Атом фосфора, окруженный объемными группами, «приделывали» к ароматическим системам, к комплексам железа или циркония. Были изучены также пары, где вместо фосфора роль донора электронов играет азот. Все такие пары исправно присоединяли Н 2по уже рассмотренной нами схеме, и в результате общая картина заметно расширилась.
Создан новый катализ
Прочтя все описанное, некоторые из читателей, возможно, подумают, что это явление, безусловно, интересное, но сводится оно, по существу, только к присоединению водорода. На самом деле происходящий ионный разрыв связи Н – Н открывает новые возможности, что сумел показать создатель таких необычных льюисовых пар Стефан, а следом за ним и другие исследователи, увлеченные подобными химическими «дуэтами».
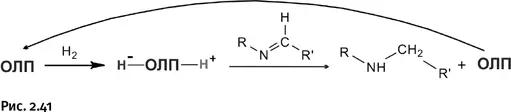
Присоединение водорода к кратным связям в молекуле – гидрирование – один из самых распространенных процессов в химической индустрии, по существу это важная стадия при получении многих продуктов: лекарств, пестицидов, пищевых добавок, витаминов. Гидрирование обычно проводят в присутствии катализаторов – веществ, которые ускоряют процесс (часто без них процесс вообще не идет, сами катализаторы в процессе реакции не расходуются). Наиболее известные катализаторы гидрирования – металлическая платина, а также комплексы родия и рутения, которые способны временно присоединять Н 2, а затем отдавать его различным органическим молекулам. Платина, родий и рутений весьма дороги, однако в процессах гидрирования они пока незаменимы. Оказалось, что ОЛП тоже способны выступать в роли катализаторов гидрирования. В первую очередь это было проверено на таком процессе, который чаще всего используют при получении различных природных соединений. Речь идет о гидрировании двойной связи во фрагменте – N=C– (напомним, что соединения, содержащие такой фрагмент, называют иминами). ОЛП присоединяет Н 2, а затем отдает его молекуле имина. Освободившаяся ОЛП может вновь присоединить Н 2и гидрировать следующую молекулу. Это классический катализ – соединение переносит реагент (Н 2), но само не расходуется и вновь возвращается в процесс, что показано на рисунке 2.41 изогнутой стрелкой.
Оказалось, что большинство из показанных ОЛП способны гидрировать различные имины. Стефан назвал такой процесс «безметаллическим» катализом.
Вернувшись к начатому немного ранее обсуждению терминологии, осмелимся предположить, что взамен предложенного Стефаном термина frustrated lewis pairs («озадаченные льюисовы пары») в практику, скорее всего, войдет более короткий и удобный термин Stephan pairs, т. е. «стефановы пары» (рис. 2.42).

В заключение отметим, что этот давно известный замысел – увеличить взаимовлечение объектов и одновременно создать затруднения для их сближения – хорошо знаком читателям любовных романов. Подобная идея также реализуется при создании некоторых механических приспособлений (тормозные устройства, пружинные механизмы), но, пожалуй, впервые она использована в химическом процессе. Из нашего рассказа вы можете заключить, что замысел оказался плодотворным. Не побоимся торжественных слов и воздадим должное автору идеи Дугласу Стефану, который буквально у нас на глазах пишет новую главу в химической науке.
Сноп валентных связей
Отдельные мысли похожи на лучи света,
но они утомляют, когда собраны в сноп.
ПЬЕР БУАСТСколько может быть связей между двумя атомами? Атомы углерода могут быть связаны одной простой связью CH 3-СН 3, но существуют также двоесвязность (в этилене CH 2=СН 2) и три связи в ацетилене СН≡СН, кроме того, тройная связь присутствует в молекуле азота N≡N и в нитрильной группе – C≡N. Мы рисуем различное количество валентных черточек, но в тени остается вопрос: а как же это было доказано? Доказательствами занимаются не только математики, разбирающие теоремы, у химиков много сил уходит на то, чтобы подтвердить строение полученного вещества или схему пути, по которому протекает реакция, зато полученный результат становится твердо установленным фактом.
Металлы заявляют о себе
Сегодня мы знаем, что кратные связи не так уж редки среди соединений металлов, но так было не всегда. До 70-х гг. ХХ в. химики даже не подозревали о том, что возможны соединения, которые содержат фрагмент М=М (М – металл). Химикам была известна комплексная соль хлоридов цезия и рения CsCl·ReCl 3; точнее будет ее изобразить по правилам координационной химии, где непосредственно вокруг рения, иначе говоря в его координационной сфере, находятся четыре иона Cl –, а катион Cs +расположен вне этой сферы Cs +[ReCl 4] –(координационную сферу принято обозначать квадратными скобками).

В 1963 г. американский химик Ф.А. Коттон из Массачусетского технологического института (рис. 2.43), изучив эту соль с помощью рентгеноструктурного анализа, установил, что истинный ее состав соответствует утроенной формуле Cs 3 +[Re 3Cl 12] 3–. Самое главное – атомы рения расположены в вершинах треугольника и связаны между собой двойнымисвязями (ионы Cl –, поставляемые хлоридом цезия, присоединены пунктирными линиями) (рис. 2.44).
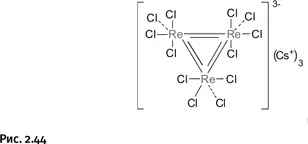
Возникает естественный вопрос: как Коттон установил, что связи между атомами рения двойные? Структурные исследования показали, что расстояние Re – Re заметно меньше, нежели в соединениях рения с одинарной связью, и даже короче, чем расстояния между атомами в металлическом рении. Кроме того, с помощью квантовохимических расчетов удалось определить кратность связи, которая оказалась равной 2 (т. е. связь двойная).
С этого соединения начался новый раздел химии, изучающий кратные связи между атомами металлов, затем появились подобные структуры с ниобием, танталом, молибденом, вольфрамом (рис. 2.45).
Читать дальшеИнтервал:
Закладка:









