Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Самые авторитетные научные журналы всегда с удовольствием помещают на своих страницах подобные иллюстрации из уважения к поэтическому настрою авторов.
Доменный процесс в органической химии
В эффектном результате всегда
замаскирован некий процесс.
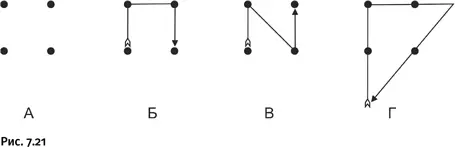
М. ЦИВЕЛЛегко ли придумать в органической химии что-то принципиально новое? Очевидно, что проделать такое в любой области человеческой деятельности не просто, тем не менее существуют некоторые рецепты. Один из них рассмотрим на примере простой задачи (рис. 7.21). На листе бумаги находятся четыре точки, расположенные по вершинам квадрата. Необходимо, не отрывая карандаша от бумаги, зачеркнуть эти четыре точки ТРЕМЯ прямыми линиями и ВЕРНУТЬСЯ в то место, с которого начали движение карандаша. На первый взгляд кажется, что, используя только три линии, вернуться в исходное место невозможно (см. варианты Б и В). Однако решение существует. Необходимо лишь выйти за пределы квадрата, внутри которого каждый, решающий эту задачу, непроизвольно «топчется». Решение – вариант Г.
Итак, надо отойти далеко в сторону от той области, в которой вы ищите решение, и постараться найти нечто нужное в другой области.
Перемещение из одной области химии в другую часто представляет собой трудную задачу, иногда такое все же удается, при этом могут получиться очень интересные результаты. Для решения одной из задач органической химии переместимся временно в область черной металлургии.
Доменный процесс
Напомним вкратце суть этого процесса. Основная цель – получение металлического железа из оксидов восстановлением с помощью элементарного углерода (кокса). Из общих соображений понятно, что взаимодействие двух твердых веществ – оксидов железа и кокса – не может быть высокоэффективным, даже если они тщательно измельчены и перемешаны. На самом деле в доменной печи протекают несколько последовательных стадий. Процесс проходит при высоких температурах (в интервале 800–1100 °С), необходимую для этого энергию дает кокс, сгорающий в потоке нагнетаемого воздуха (рис. 7.22).
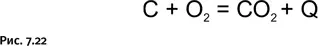
Образовавшийся СО 2реагирует с избыточным количеством несгоревшего кокса, образуя монооксид углерода СО – угарный газ (рис. 7.23).
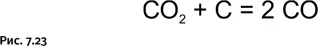
Именно монооксид углерода ведет весь дальнейший процесс, постепенно восстанавливая различные оксиды железа до металла (рис. 7.24).
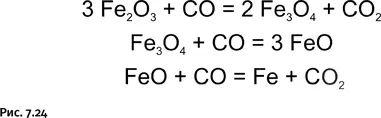
Доменный процесс детально описан во множестве учебников и на первый взгляд не позволяет прийти к каким-либо новым идеям, тем более применимым в органической химии, поскольку температуры, при которых протекают реакции в доменной печи, для органических соединений недопустимы. Однако не будем торопиться и постараемся посмотреть на все это свежим взглядом. Схемы реакций показывают, что СО работает в качестве классического восстановителя – «уносит» с собой атомы О, забирая их у оксидов железа.
Теперь вспомним, что в органической химии тоже существуют реакции восстановления. Но можно ли применить СО для тех же целей в органических синтезах? Вначале познакомимся с тем, как используют монооксид углерода химики-органики.
Монооксид углерода в органической химии
При повышенных температурах СО реагирует с щелочами, образуя формиаты (рис. 7.25).
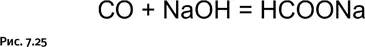
В присутствии платинового катализатора СО реагирует с NH 3, давая цианат аммония NH 4NCO, который изомеризуется в мочевину (рис. 7.26).
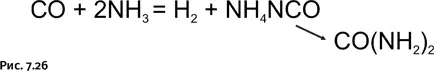
Под действием света СО реагирует с Cl 2, образуя фосген COCl 2. Широко известна способность СО реагировать с металлами, образуя летучие соединения – карбонилы металлов, например Ni(CO) 4(t кип.= 43 °С), что используют для высокой очистки никеля. С галогенидами некоторых металлов он образует комплексные соединения, такие как OsCl 2(CO) 3и PtCl 2(CO).
Монооксид углерода широко используют для промышленного получения метанола (рис. 7.27), а также насыщенных и ненасыщенных углеводородов в присутствии различных катализаторов (синтез Фишера – Тропша) (рис. 7.28).
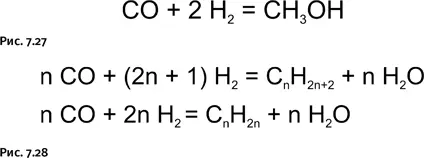
Каталитическое взаимодействие СО с ароматическими углеводородами приводит к соответствующим альдегидам (рис. 7.29).

Современный способ получения уксусной кислоты – присоединение СО к метанолу в присутствии катализаторов – солей кобальта, родия или иридия (рис. 7.30).

Подведем итог. Монооксид углерода необычайно широко применяют в органической химии, однако он выступает только в качестве присоединяющегося реагента, и мы не видим случаев, когда бы он проявил себя как восстановитель, который, уходя, уносит с собой атом кислорода.
Реакции восстановления в органической химии
Посмотрим далее, как проводят химики-органики реакции восстановления. Наиболее широко используют процесс гидрирования – присоединение молекулы водорода к кратным связям в молекуле (рис. 7.31).
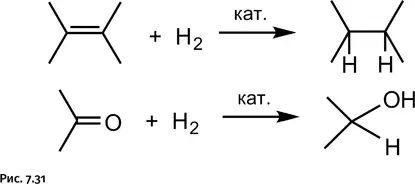
Вот перечень некоторых реакций восстановления водородом, используемых в органической химии:
● алкены превращаются в алканы (R 2C=CR 2→ R 2CH – CHR 2);
● алкины → в алкены (RC≡CR → RCH=CHR);
● альдегиды → в первичные спирты (RCHO → RCH 2OH);
● кетоны → во вторичные спирты (RCOR’ → RR’CHOH);
● карбоновые кислоты → в первичные спирты (RCOOH → RCH 2OH);
● сложные эфиры → в два спирта (RCOOR’ → RCH 2OH, R’OH);
● имины → в амины (R 2C=NR’ → R 2CH – NHR’);
● амиды → в амины (RC(O)NR’ 2→ RCH 2NR’ 2);
● нитрилы → в амины или имины (RCN → RCH-NH 2,RCH=NH);
Читать дальшеИнтервал:
Закладка:









