Константин Ефанов - Механизмы неорганических реакций выплавки чугуна и стали
- Название:Механизмы неорганических реакций выплавки чугуна и стали
- Автор:
- Жанр:
- Издательство:Array SelfPub.ru
- Год:2021
- ISBN:978-5-532-03580-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Константин Ефанов - Механизмы неорганических реакций выплавки чугуна и стали краткое содержание
Механизмы неорганических реакций выплавки чугуна и стали - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
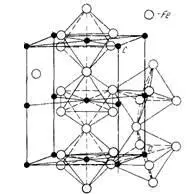
Такой структуре соответствует структура бейнита (пресыщенный углеродом раствор феррита и Fe 3C). Бейнит AB3_hP8_182_c_g по данным [30]:
Сравнивая рисунки, видим, что в структуре бейнита по данным [30] имеются октаэдры, отмеченные на рисунке Гуляева [9,с.148]. Отметим, что бейнит получается в результате распада мартенсита.
Таким образом, видим, что две отличающиеся структуры образуются в разных процессах – первая при выплавке чугуна, вторая – при распаде мартенсита в процессах изготовления стали. Т.е. противоречия отсутствуют – в процессе выплавки чугуна образуется цементит Fe 3C , D0AB3_oP16_62_c_cd), а при изготовлении стали бейнит Fe (AB3_hP8_182_c_g). 11( 3C
__
Выше была приведена структура графита по данным Полинга [1]. Кокс, используемый для получения газа СО имеет отличающуюся структуру от графита, например, Луазон Р. приводит следующую структуру кокса [34,с.31]:
Запись схемы реакции С + О → СО → СО 2означает окисление кислородом сложной структуры кокса из конденсированных ароматических ядер. По условиям реакции горения образуется газ СО.
В работе [35,с.68] описывается механизм окисления кокса в виде: кислород взаимодействует с глобулой кокса с образованием кислород-углеродного комплекса. Комплекс разрушается с выделением газа СО или СО 2. Под комплексом по-видимому понимается комплекс с ароматическим ядром.
Реакция 3Fe + C → 3FeC предполагает по записи прямое взаимодействие железа со связями углеводорода. Такое взаимодействие можно ориентировочно представиться схемой:
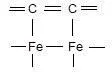
Однако, процесс взаимодействия по схеме 3Fe + C → 3FeC является намного более сложным. По этой схеме происходит перекрывание между орбиталями углерода и железа с образованием общей орбитали. В случае наличия связи С-С возможно её раскрытие с образованием связей Fe-C. Однако, схема представляет устаревший подход к изображению механизмов реакций и реалистичную картину взаимодействия можно получить по результатам квантово-механического расчета.
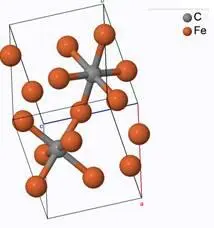
Для информации приведем структуру FeO 2(гетит) C25 A2B_oP12_62_2c_c по данным [30]:

А также приведем структуру Fe 2C AB2_oP6_58_a_g (об образовании структуры в процессе выплавки чугуна и стали данные отсутствуют) по данным [30]:

Рассмотрим проблему взаимодействия шлаков с огнеупорным слоем оборудования. Вест отмечает [37,с.258] для взаимодействия с футеровкой шлаку необходимо смочить керамику. Условие смачивания состоит в том, что поверхностное натяжение на границе жидкость-воздух больше поверхностного натяжения на границе между шлаком и огнеупором. Для жидких металлов условие не выполняется. Взаимодействие шлака с огнеупором зависит от способности шлака снижать температуру плавления огнеупорного материала. Используемый кирпич должен быть устойчивым к расплавленному оксиду железа.
Механизмы реакций выплавки стали
Сталь получают из чугуна снижением содержания углерода и удалением растворенных примесей марганца, кремния, серы, фосфора. Основной реакцией является окисление углерода [6,с.98] для получения стали из чугуна, в котором содержание углерода до 4%.
В отличии от доменных печей, в сталеплавильных агрегатах атмосфера окислительная.
Окислительная атмосфера создается продувки ванны со сталью кислородом.
__
Железо, являсь основным компонентом, окисляется до оксида FeO. Этот оксид затем вступает в химические реакуии окисления примесей, в результате которых железо вновь восстанавливается.
Fe + О 2→ 2FeО
2FeO + Si → SiO 2+ 2Fe
FeO + Mn → MnO + Fe
FeO + С → CO + Fe
Вместе с тем, окисление примесей может происходить кислородом напрямую:
С + О 2→ СО → СО 2
Si + О 2→ SiО 2
2Mn + О 2→ 2MnО
__
В химии углеводородов рассматриваются механизмы реакций на поверхности кристалла. Считается, что молекулы перед взаимодействием адсорбируются на поверхности металла и за счет связей с металлом, ослабляются связи в молекулах, после чего становится возможным реакция между двумя молекулами и десорбция продуктов с поверхности. Например, для таких процессов можно записать схему:
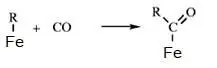
В механизмах реакций в кристаллах отличие состоит в том, что молекулы входят в состав кристаллической решетки и реакции происходят в слоях решетки.
Схему превращений кислорода можно записать в виде [35,с.39]:
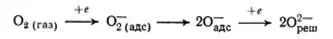
Молекулы О 2распадаются на два иона, которые перемещаются в вакансии решетки (в пустоты решетки) и образуют химическую связь с атомами железа. После химической адсорбции О 2на поверхности, происходит перенос электрона из решетки на молекулу О 2. После этого молекула О 2диссоциирует на ионы. Центр адсорбции перестраивается и кислород переходит в структуру решетки кристалла. Кислород может находиться кроме ионов в виде поверхностных окислов различного состава.
Перестройка поверхности решетки металла происходит под действием химической адсорбции или непосредственно из-за реакций окисления [35,с40].
Для кислорода можно предположить существование вид химической абсорбции:

Точные представления получаются квантово-механически расчетом для кластера. Затем происходит распад связи О-О и встраивание кислородного радикала в решетку.
Полинг в работе [35,с.179] указывает структуру кислорода в виде бирадикала с двумя неспаренными атомами:
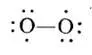
Структура с двойной связью является ошибочной [35,с.179]:
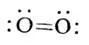
Молекула кислорода имеет электронную конфигурацию:
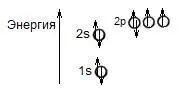
находится в триплетном состоянии, т.е. с одним неспаренным электроном на одной орбитали.
Читать дальшеИнтервал:
Закладка: