Е. Невская - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Е. Невская - Сборник основных формул по химии для ВУЗов краткое содержание
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Заполнение МО электронами происходит по тем же правилам, что и заполнение АО в атоме, а именно: правилу Паули (на МО не может быть более двух электронов), правилу Хунда (суммарный спин должен быть максимален) и т. д.
Взаимодействие 1s-AO атомов первого периода (Н и Не) приводит к образованию связывающей σ-МО и разрыхляющей σ*-МО:

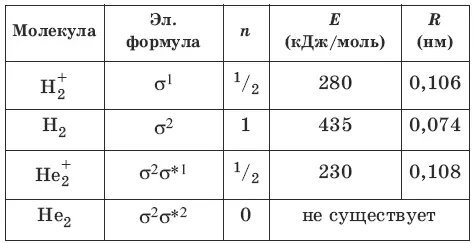
Электронные формулы молекул, порядки связей n, экспериментальные энергии связей Е и межмолекулярные расстояния R для двухатомных молекул из атомов первого периода приведены в следующей таблице:
Другие атомы второго периода содержат, помимо 2s-AO, также и 2р х-, 2р y– и 2р z-АО, которые при взаимодействии могут образовывать σ– и π-MO. Для атомов О, F и Ne энергии 2s– и 2р-АО существенно различаются, и можно пренебречь взаимодействием 2s-AO одного атома и 2р-АО другого атома, рассматривая взаимодействие между 2s-AO двух атомов отдельно от взаимодействия их 2р-АO. Схема МО для молекул O 2, F 2, Ne 2имеет следующий вид:

Для атомов В, С, N энергии 2s– и 2р-АО близки по своим энергиям, и 2s-AO одного атома взаимодействует с 2р z-АО другого атома. Поэтому порядок МО в молекулах В 2, С 2и N 2отличается от порядка МО в молекулах O 2, F 2и Ne 2. Ниже приведена схема МО для молекул В 2, С 2и N 2:

На основании приведенных схем МО можно, например, записать электронные формулы молекул O 2, O 2 +и O 2¯:
O 2 +(11ē)σ s 2σ s *2σ z 2(π x 2π y 2)(π x *1π y *0)
n = 2 R = 0,121 нм;
O 2(12ē)σ s 2σ s *2σ z 2(π x 2π y 2)(π x *1π y *1)
n = 2,5 R = 0,112 нм;
O 2¯(13ē)σ s 2σ s *2σ z 2(π x 2π y 2)(π x *2π y *1)
n = 1,5 R = 0,126 нм.
В случае молекулы O 2теория МО позволяет предвидеть большую прочность этой молекулы, поскольку n = 2, характер изменения энергий связи и межъядерных расстояний в ряду O 2 +– O 2– O 2¯, а также парамагнетизм молекулы O 2, на верхних МО которой имеются два неспаренных электрона.
3.3. Некоторые виды связей
Ионная связь– электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться как предельный случай ковалентной полярной связи. Ионная связь образуется, если разница электроотрицательностей атомов ΔХ больше чем 1,5–2,0.
Ионная связь является ненаправленной ненасыщаемой связью. В кристалле NaCl ион Na +притягивается всеми ионами Cl¯ и отталкивается всеми другими ионами Na +, независимо от направления взаимодействия и числа ионов. Это предопределяет большую устойчивость ионных кристаллов по сравнению с ионными молекулами.
Водородная связь– связь между атомом водорода одной молекулы и электроотрицательным атомом (F, CI, N) другой молекулы.
Существование водородной связи объясняет аномальные свойства воды: температура кипения воды гораздо выше, чем у ее химических аналогов: t кип(Н 2O) = 100 °С, а t кип(H 2S) = -61°C. Между молекулами H 2S водородные связи не образуются.
4. Закономерности протекания химических процессов
4.1. Термохимия
Энергия (Е) – способность производить работу. Механическая работа (А) совершается, например, газом при его расширении: А = р • ΔV.
Реакции, которые идут с поглощением энергии, – эндотермические.
Реакции, которые идут с выделением энергии, – экзотермические.
Виды энергии:теплота, свет, электрическая, химическая, ядерная энергия и др.
Типы энергии:кинетическая и потенциальная.
Кинетическая энергия– энергия движущегося тела, это работа, которую может совершить тело до достижения им покоя.
Теплота (Q)– вид кинетической энергии – связана с движением атомов и молекул. При сообщении телу массой (m) и удельной теплоемкостью (с) теплоты ΔQ его температура повышается на величину Δ t: ΔQ = m • с • Δt, откуда Δ t = ΔQ/(c • т).
Потенциальная энергия– энергия, приобретенная телом в результате изменения им или его составными частями положения в пространстве. Энергия химических связей – вид потенциальной энергии.
Первый закон термодинамики:энергия может переходить из одного вида в другой, но не может исчезать или возникать.
Внутренняя энергия (U) – сумма кинетической и потенциальной энергий частиц, составляющих тело. Поглощаемая в реакции теплота равна разности внутренней энергии продуктов реакции и реагентов (Q = ΔU = U 2– U 1), при условии, что система не совершила работы над окружающей средой. Если реакция идет при постоянном давлении, то выделяющиеся газы совершают работу против сил внешнего давления, и поглощаемая в ходе реакции теплота равна сумме изменений внутренней энергии ΔU и работы А = р • ΔV. Эту поглощаемую при постоянном давлении теплоту называют изменением энтальпии: Δ Н = ΔU + р • ΔV, определяя энтальпию как Н = U + pV. Реакции жидких и твердых веществ протекают без существенного изменения объема (ΔV = 0), так что для этих реакций Δ Н близка к ΔU (ΔН = ΔU ). Для реакций с изменением объема имеем ΔН > ΔU , если идет расширение, и ΔН < ΔU , если идет сжатие.
Изменение энтальпии обычно относят для стандартного состояния вещества: т. е. для чистого вещества в определенном (твердом, жидком или газообразном) состоянии, при давлении 1 атм = 101 325 Па, температуре 298 К и концентрации веществ 1 моль/л.
Стандартная энтальпия образования ΔН обр– теплота, выделяемая или поглощаемая при образовании 1 моль вещества из простых веществ, его составляющих, при стандартных условиях. Так, например, ΔН обр (NaCl) = -411 кДж/моль. Это означает, что в реакции Na(тв) + ½Cl 2(г) = NaCl(тв) при образовании 1 моль NaCl выделяется 411 кДж энергии.
Стандартная энтальпия реакции ΔН– изменение энтальпии в ходе химической реакции, определяется по формуле: ΔН= ΔН обр (продуктов) – ΔН обр (реагентов).
Так для реакции NH 3(г) + HCl(г) = NH 4Cl(тв), зная ΔH o 6 p(NH 3)=-46 кДж/моль, ΔH o 6 p(HCl) = -92 кДж/моль и ΔH o 6 p(NH 4Cl) = -315 кДж/моль имеем:
ΔH = ΔH o 6 p(NH 4Cl) – ΔH o 6 p(NH 3) – ΔH o 6 p(HCl) = -315 – (-46) – (-92) = -177 кДж.
Если Δ Н < 0, то реакция экзотермическая. Если Δ Н > 0, то реакция эндотермическая.
ЗаконГесса: стандартная энтальпия реакции зависит от стандартных энтальпий реагентов и продуктов и не зависит от пути протекания реакции.
Самопроизвольно идущие процессы могут быть не только экзотермическими, т. е. процессами с уменьшением энергии ( Δ Н < 0), но могут быть и эндотермическими процессами, т. е. процессами с увеличением энергии ( Δ Н > 0). Во всех этих процессах «беспорядок» системы увеличивается.
Читать дальшеИнтервал:
Закладка:










