Е. Невская - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Е. Невская - Сборник основных формул по химии для ВУЗов краткое содержание
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
М. А. Рябов, Е. Ю. Невская, Е. А. Сорокина, Т. Ф. Шешко
Сборник основных формул по химии
Краткий справочник студента
I. Общая химия
1. Основные понятия химии
Химия– наука о составе, строении, свойствах и превращениях веществ.
Атомно-молекулярное учение.Вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом– нейтральная частица, состоящая из положительного ядра и электронов.
Молекула– устойчивая группа атомов, связанных химическими связями.
Химический элемент– вид атомов с одинаковым зарядом ядра. Элемент обозначают
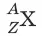
где X – символ элемента, Z – порядковый номер элемента в Периодической системе элементов Д.И. Менделеева, A – массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число A равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности A – Z.
Изотопы– атомы одного элемента, имеющие разные массовые числа.
Относительная атомная масса(A r) – отношение средней массы атома элемента естественного изотопического состава к 1/ 12массы атома изотопа углерода 12С.
Относительная молекулярная масса(M r) – отношение средней массы молекулы вещества естественного изотопического состава к 1/ 12части массы атома изотопа углерода 12С.
Атомная единица массы(а.е.м) – 1/ 12часть массы атома изотопа углерода 12С. 1 а.е. м = 1,66 × 10 -24г.
Моль– количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль– количество вещества, содержащее 6,02 • 10 23структурных единиц (атомов, молекул, ионов).
n = N/N A, где n – количество вещества (моль), N – число частиц, a N A – постоянная Авогадро. Количество вещества может обозначаться также и символом v.
Постоянная Авогадро N A= 6,02 • 10 23частиц/моль.
Молярная масса M (г/моль) – отношение массы вещества m (г) к количеству вещества n (моль):
М = m/n, откуда: m = М • n и n = m/М.
Молярный объем газа V M (л/моль) – отношение объема газа V (л) к количеству вещества этого газа n (моль). При нормальных условиях V M= 22,4 л/моль.
Нормальные условия:температура t = 0°C, или Т = 273 К, давление р = 1 атм = 760 мм. рт. ст. = 101 325 Па = 101,325 кПа.
V M= V/n, откуда: V = V M• n и n = V/V M.
В результате получается общая формула:
n = m/M = V/V M= N/N A.
Эквивалент– реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким-либо другим способом.
Молярная масса эквивалентов М э– отношение массы вещества к количеству эквивалентов этого вещества: М э= m/n ( экв ).
В реакциях обмена зарядов молярная масса эквивалентов вещества
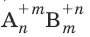
с молярной массой М равна: М э= М/(n × m).
В окислительно-восстановительных реакциях молярная масса эквивалентов вещества с молярной массой М равна: М э= М/n(ē), где n(ē) – число переданных электронов.
Закон эквивалентов– массы реагирующих веществ 1 и 2 пропорциональны молярным массам их эквивалентов. m 1/m 2 = М Э1/М Э2, или m 1/М Э1= m 2/М Э2, или n 1= n 2, где m 1 и m 2 – массы двух веществ, М Э1 и М Э2 – молярные массы эквивалентов, n 1 и n 2 – количества эквивалентов этих веществ.
Для растворов закон эквивалентов может быть записан в следующем виде:
c Э1 • V 1= c Э2 • V 2 , где с Э1, с Э2, V 1 и V 2 – молярные концентрации эквивалентов и объемы растворов этих двух веществ.
Объединенный газовый закон: pV = nRT, где p – давление (Па, кПа), V – объем (м 3, л), n – количество вещества газа (моль), T – температура (К), T (К) = t (°C) + 273, R – константа, R = 8,314 Дж/(К × моль), при этом Дж = Па • м 3= кПа • л.
2. Строение атома и Периодический закон
Корпускулярно-волновой дуализмматерии – представление о том, что каждый объект может иметь и волновые, и корпускулярные свойства. Луи де Бройль предложил формулу, связывающую волновые и корпускулярные свойства объектов: λ = h/(mV), где h – постоянная Планка, λ – длина волны, которая соответствует каждому телу с массой m и скоростью V. Хотя волновые свойства существуют для всех объектов, но наблюдаться они могут лишь для микрообъектов, имеющих массы порядка массы атома и электрона.
Принцип неопределенности Гейзенберга: Δ(mV x) • Δх > h/2n или ΔV x• Δx > h/(2πm), где m – масса частицы, x – ее координата, V x – скорость в направлении x, Δ – неопределенность, погрешность определения. Принцип неопределенности означает, что нельзя одновременно сколь угодно точно указать положение (координату x) и скорость (V x) частицы.
Частицы с маленькими массами (атомы, ядра, электроны, молекулы) не являются частицами в понимании этого механикой Ньютона и не могут изучаться классической физикой. Они изучаются квантовой физикой.
Главное квантовое число n принимает значения 1, 2, 3, 4, 5, 6 и 7, соответствующие электронным уровням (слоям) К, L, M, N, О, Р и Q.
Уровень– пространство, где расположены электроны с одинаковым числом n. Электроны разных уровней пространственно и энергетически отделены друг от друга, поскольку число n определяет энергию электронов Е (чем больше n, тем больше Е) и расстояние R между электронами и ядром (чем больше n, тем больше R).
Орбитальное (побочное, азимутальное) квантовое число l принимает значения в зависимости от числа n: l = 0, 1,…( n – 1). Например, если n = 2, то l = 0, 1; если n = 3, то l = 0, 1, 2. Число l характеризует подуровень (подслой).
Подуровень– пространство, где расположены электроны с определенными n и l. Подуровни данного уровня обозначаются в зависимости от числа l: s – если l = 0, p – если l = 1, d – если l = 2, f – если l = 3. Подуровни данного атома обозначаются в зависимости от чисел n и l, например: 2s (п = 2, l = 0), 3d (n = 3, l = 2) и т. д. Подуровни данного уровня имеют разную энергию (чем больше l, тем больше Е): E s< E < Е А< … и разную форму орбиталей, составляющих эти подуровни: s-орбиталь имеет форму шара, p -орбиталь имеет форму гантели и т. д.
Читать дальшеИнтервал:
Закладка:










