А. Дроздов - Неорганическая химия
- Название:Неорганическая химия
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2008
- Город:Москва
- ISBN:978-5-699-26628-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Дроздов - Неорганическая химия краткое содержание
Информативные ответы на все вопросы курса «Неорганическая химия» в соответствии с Государственным образовательным стандартом.
Неорганическая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Например, гидроксид цинка при взаимодействии с кислотами ведет себя как основание:
Zn(OH) 2+ 2HCI – ZnCI 2 + 2Н 2О,
а при взаимодействии с щелочами – как кислота:
Zn(ОН) 2+ 2NaOH → Na 2[Zn (OH) 4].
23. Буферные системы крови.Плазма крови
Большое значение буферные системы имеют в под–держании кислотно-основного равновесия организмов. Внутриклеточные и внеклеточные жидкости всех живых организмов характеризуются постоянным значением рН, которое поддерживается с помощью буферных систем. Значение рН большей части внутриклеточных жидко–стей находится в интервале от 6,8 до 7,8.
Кислотно-основное равновесие КО-равновесия в крови человека обеспечивается водород-карбонатной, фосфат–ной и белковой буферными системами.
Нормальное значение рН плазмы крови составляет 7,40 ± 0 05. Этому соответствует интервал значений активной кислотности от 3,7 до 4,0х10 -8 моль/л. Так как в крови присутствуют различные электролиты (HC0 3–, H 2CO 3, Н 2РО 4–, НРО 4 2-), белки, аминокислоты, это озна–чает, что они диссоциируют в такой степени, чтобы ак–тивность а(Н+) находилась в указанном интервале.
В связи с тем что содержание неорганических и ор–ганических веществ в плазме и клетках крови неоди–наково, целесообразно рассмотреть эти составляющие крови отдельно.
Плазма крови
Водород-карбонатная буферная система НСО 3–/ Н 2СО 3состоит из угольной кислоты Н 2СО 3и сопряжен–ного основания НСО 3–. Это наиболее важная буфер–ная система крови. Одим из компонентов – угольная кислота Н 2СО 3– образуется при взаимодействии раст–воренного в плазме СО 2с водой:
СО 2(р)+ Н 2О н Н 2СО 3.
где СО 2(р)– концентрация растворенного СО 2.
Константа равновесия этой реакции:
К = [Н 2СО 3] / [СО 2]
Между СО 2в альвеолах и водород-карбонатным буфером в плазме крови, протекающей через ка–пилляры легких, устанавливается цепочка равновесий.
Водород-карбонатная буферная система действует как эффективный физиологический буферный раствор вблизи рН7,4.
При поступлении в кровь кислот – доноров Н + равно–весие в цепочке по принципу Ле Шателье смещается влево в результате того, что ионы НСО 3связывают ионы Н в молекулы Н 2СО 3. При этом концентрация Н 2СО 3по–вышается, а концентрация ионов НСО 3понижается. По–вышение концентрации Н 2СО 3приводит к смещению равновесия влево, (принцип Ле Шателье). Это вызывает распад Н 2СО 3и увеличение концентрации СО 2, раство–ренного в плазме. В результате смещается равновесие влево и повышается давление СО 2в легких. Избыток СО 2выводится из организма.
В результате водород-карбонатная система крови быстро приходит в равновесие с СO 2в альвеолах и эф–фективно обеспечивает поддержание постоянства рН плазмы крови.
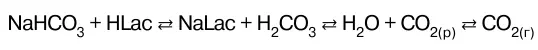
Таким образом, поддерживается нормальное зна–чение рН крови при слабо выраженном сдвиге рН, об–условленном ацидозом.
В замкнутых помещениях часто испытывают удушье (нехватку кислорода), учащение дыхания. Однако удушье связано не столько с недостатком кислорода, сколько с избытком СО 2 .
Избыток СO 2в атмосфере согласно закону Генри при–водит к дополнительному растворению СO 2в крови. А это приводит к понижению рН крови, т. е. к ацидозу.
Водород-карбонатная буферная система наиболее быстро отзывается на изменение рН крови. Ее буферная емкость по кислоте составляет В к= 40 ммоль/л плазмы крови, а буферная емкость по щелочи значительно мень–ше и равна примерно В щ= 1—2 ммоль/л плазмы крови.
24. Реакции нейтрализации
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в резуль–тате которых образуются соль и вода.
Рассмотрим различные типы реакций нейтрализации.
1. Нейтрализация сильного основания сильной кис–лотой:
КОН + HNO 3– KNO 3+ Н 2 O .
Молекулярно-ионное уравнение такой реакции Н ++ OН - → Н 2O
и отрицательное значение энергии Гиббса ΔG° пока–зывают, что равновесие практически смещено в сто–рону образования воды.
Общим случаем реакции нейтрализации является взаимодействие кислот и оснований, различающихся по силе (степени диссоциации). Эти реакции не дохо–дят до конца вследствие протекания обратной реакции гидролиза соли.
2. Нейтрализация слабой кислоты сильным основа–нием:
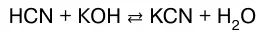
или в молекулярно-ионном виде:
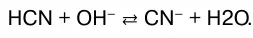
В данном случае реакция нейтрализации обратима. Обратима и реакция нейтрализации слабого основа–ния сильной кислотой:
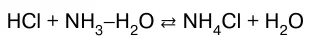
или в молекулярно-ионном виде:
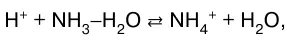
а также – слабого основания слабой кисло–той:
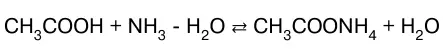
или в молекулярно-ионном виде:
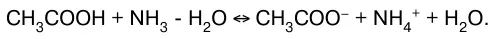
В данных системах равновесие сильно смещено вправо, так как вода значительно более слабый элек–тролит, чем синильная кислота, аммиак и уксусная ки–слота.
Реакции нейтрализации лежат в основе метода нейтра–лизации. Этот метод используют в клинических лабора–ториях для определения кислотности желудочного сока, буферной емкости плазмы крови. В фармакологии его применяют для количественного анализа неорганиче–ских кислот (соляной, серной, борной) и органических кислот (уксусной, бензойной, винной, лимонной, сали–циловой). В биофармацевтических исследованиях методом нейтрализации определяют рК а кислот и рК ь оснований, так как по значению этих величин можно прогнозировать способность лекарственных препара–тов проходить через биологические мембраны.
Применяют кислотно-основное титрование для опре–деления рК ааминокислот и рК адиссоциирующих групп, входящих в белки. По кривым титрования белков, полу–ченным при двух различных температурах, можно опре–делить число карбоксильных, имидазольных и других групп. Титрование аминокислот и белков дает возмож–ность определить их изоэлектрические точки.
Под гидролизом понимают реакцию разложения ве–щества водой.
Гидролизу могут подвергаться химические соедине–ния различных классов: белки, жиры, углеводы, эфиры, соли и т. д. В неорганической химии чаще всего встре–чаются с гидролизом солей.
Читать дальшеИнтервал:
Закладка:










