А. Дроздов - Неорганическая химия
- Название:Неорганическая химия
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2008
- Город:Москва
- ISBN:978-5-699-26628-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Дроздов - Неорганическая химия краткое содержание
Информативные ответы на все вопросы курса «Неорганическая химия» в соответствии с Государственным образовательным стандартом.
Неорганическая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
25. Гидролиз соли
Гидролиз соли– это взаимодействие соли с мо–лекулами воды, приводящее к образованию малодис-социироваииых соединений.
Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону (СO 3 2-+ НОН * НСO 3 –+ ОН -) или от данного иона, в том числе от гидратиро-ванного катиона металла, к молекуле воды.
В зависимости от природы соли вода выступает ли–бо как кислота, либо как основание, а соль является соответственно сопряженным основанием или сопря–женной кислотой.
Возможны четыре варианта гидролиза в зависимо–сти от типа соли.
1. Соли, образованные сильной кислотой и слабым основанием:
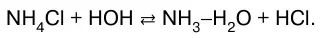
2. Соли, образованные сильным основанием и сла–бой кислотой:
CH 3COONa + НОН → СН 3СOOН + NaOH.
3. Соли, образованные слабой кислотой и слабым основанием.
Цианид аммония гидролизуется по реакции:

4. Соли, образованные сильной кислотой и сильным основанием.
NaCl, KNO 3 гидролизу не подвергаются. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболоч–кой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одно– основными кислотами. Соли многоосновных кис–лот и многокислотных оснований гидролизуются ступенчато, образуя при этом кислые и основные соли.
Количественно гидролиз как КО-равновесие характе–ризуется степенью гидролиза и константой гидролиза.
Степень гидролиза измеряется отношением коли–чества гидролизованного вещества к общему коли–честву растворенного вещества.
Степень гидролиза зависит от природы соли, ее кон–центрации и температуры. Согласно закону действую–щих масс степень гидролиза возрастает с разбавлением раствора. Так, при концентрации
Na 2CO 30,001 моль/л степень гидролиза составляет 34%.
В общем случае справедливы следующие законо–мерности.
1. Гидролиз соли должен усиливаться с повыше–нием температуры и разбавлением раствора.
2. При обратимом гидролизе в соответствии с прин–ципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кис–лотой и слабым основанием, накапливаются ионы Н) или при подщелачивании (если соль образована сла–бой кислотой и сильным основанием, накапливаются ионы ОН).
3. Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляю–щиеся из сферы реакции (принцип смещения равнове–сия), необратим. Например, гидролиз Pb(SO 4) 2проте–кает полностью вследствие образования осадка PbO 2:
Pb(SO 4) 2+ 2Н 2O → PbO 2 + 2H 2SO 4.
Гидролиз характерен для многих классов неоргани–ческих и органических соединений. Гидролиз неорга–нических соединений важен для оценки их токсично–сти. Гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и иного, но особенно важную роль гидролиз играет в жизнедеятельности живых организмов.
26. Реакция осаждения и растворения
К обменным реакциям, протекающим в растворе элект–ролитов, относятся реакции осаждения и растворения.
Реакции осаждения сопровождаются выпадени–ем осадков.
Реакции, сопровождающиеся растворением осадков, называются реакциями растворения.
Широко используют системы, состоящие из осадка труднорастворимого электролита и насыщенного раст–вора над ним. В таких системах между насыщенным раствором и осадком устанавливается динамическое равновесие. Вследствие низкой растворимости концен–трация труднорастворимого электролита в растворе очень мала, поэтому можно считать, что в растворе он полностью диссоциирован. Иначе говоря, динамиче–ское равновесие в насыщенном растворе устанавлива–ется между твердой фазой вещества и перешедшими в раствор ионами. Например, в насыщенном растворе AgCl имеет место равновесие:
Ag Cl( T) → Ag + (p)+ Cl - (р) .
Концентрация твердой фазы AgCl как величина по–стоянная из выражения для константы равновесия ис–ключается. Вследствие этого константа равновесия определяется только произведением концентраций ио–нов в растворе и называется константой или произведе–нием растворимости. В общем случае для электролита Kt n An m константа растворимости определяется стехио-метрическим произведением концентраций ионов:
К пр= [Kt m+] n[An n–] m
Эта величина характеризует растворимость электро–лита при постоянной температуре в отсутствие посто–ронних веществ.
Постоянство К прне означает постоянства кон–центраций отдельных ионов в растворе. Так, можно увеличить концентрацию ионов Ag в насыщенном раст–воре AgCl, добавив, например, AgNO 3, при этом равно–весие по принципу Ле Шателье сместится влево, что приведет к увеличению скорости осаждения ионов. Через некоторое время скорости растворения AgCl и осажде–ния ионов Ag и Cl сравняются. Вновь установившееся равновесие будет, как и прежде, характеризоваться ве–личиной К пр(AgCl), но равновесные концентрации ио–нов Ag и Cl изменятся.
Таким образом, на основе К прможно прогнозиро–вать образование и растворение осадков электроли–тов на основе двух правил.
1. Электролит выпадает в осадок, когда стехиомет-рическое произведение концентраций его ионов в раст–воре больше константы растворимости.
2. Осадок электролита растворяется, когда стехио-метрическое произведение концентраций составляю–щих его ионов в растворе становится меньше констан–ты растворимости.
Реакции осаждения лежат в основе метода осажде–ния, который применяется в количественном анализе фармацевтических препаратов. Метод осаждения ис–пользуется в клиническом анализе хлоридов в моче, желудочном соке, крови, в санитарно-гигиенической практике – при анализе питьевой воды. Ученые счи–тают, что различная растворимость природных соеди–нений элементов в воде оказала большое влияние на их содержание в живых организмах. Между раствори–мостью соединений в воде и токсическим действием ионов ряда элементов имеется тесная взаимосвязь. Например, введение Al 3+ в организм вследствие обра–зования малорастворимого фосфата алюминия AlPO 4
27. Окислительно-восстановительные реакции
Одним из основных понятий неорганической химии является понятие о степени окисления (СО).
Степенью окисления элемента в соединении на–зывается формальный заряд атома элемента, вычис–ленный из предположения, что валентные электроны переходят к атомам с большей относительной электро–отрицательностью (ОЭО) и все связи в молекуле сое–динения являются ионными.
Читать дальшеИнтервал:
Закладка:










