Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
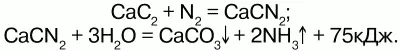
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
31. Соли аммония
Соли аммония– сложные вещества, включающие катионы аммония NH4+и кислотные остатки.
Физические свойства:соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства:аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди:
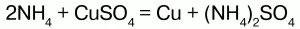
Соли аммония имеют ионную решетку и обладают всеми свойствами типичных солей:
1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:
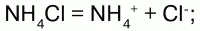
2) подвергаются гидролизу (соль слабого основания и сильной кислоты):
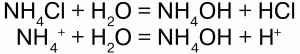
среда кислая, рН<7, лакмус красный;
3) вступают в обменную реакцию с кислотами и солями:
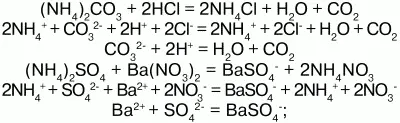
4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
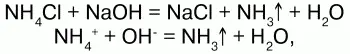
соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса;
5) разлагаются при нагревании:
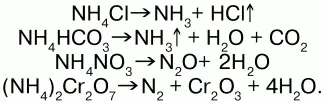
Получение:NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O.
Применение:соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь.
32. Оксиды азота
С кислородом Nобразует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O –закись азота, «веселящий газ» . Физические свойства:бесцветный, со сладковатым запахом, растворим в воде, t плавления -91 °C, t кипения -88,5 °C. Анестезирующее средство.
Химические свойства:разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O.
Получение:NH4NO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий.
Оксид азота (II) NO –окись азота. Физические свойства:бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C.
Химические свойства: NO обладает окислительно-восстановительными свойствами:
1) при обычной температуре устойчив, при понижении t димеризуется в N2O2;
2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем;
3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2? + Н2O, где NO – окислитель;
4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий.
Получение:
1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O;
2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO? + 6H2O;
3) NO образуется в грозу: N2 + O2 = 2NO?.
Оксид азота (III) N203. Физические свойства:темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства:N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O.
Получение:NO2 + NO = N2O3.
Оксид азота (IV)– NO2. Физические свойства:ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства:кислотный ангидрид:
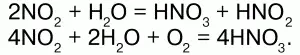
Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O.
Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость).
Получение:2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства:малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства:ангидрид HN03.
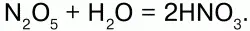
Разлагается со взрывом: 2N2O5?4NO2 + О2.
Получение:
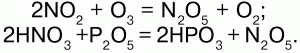
33. Азотная кислота
Азотная кислота– бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3.
Физические свойства.При температуре 42 °C застывает в виде белых кристаллов. Безводная азотная кислота закипает при атмосферном давлении и 86 °C. С водой смешивается в произвольных соотношениях.
Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
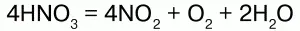
HNO3 хранят в прохладном и темном месте. Валентность азота в ней – 4, степень окисления – +5, координационное число – 3.
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий:
Читать дальшеИнтервал:
Закладка:









