Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Каучук с высоким содержанием серы называется эбонит, являющийся качественным электрическим изолятором. Для уничтожения некоторых сельскохозяйственных вредителей серу применяют в виде серного цвета. Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
26. Сероводород и сульфиды
Сероводород (H2S) –бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.
Физические свойства:сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота.
Химические свойства: сероводород– сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты:
1) горит голубоватым пламенем на воздухе:
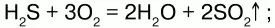
2) при высокой температуре разлагается:
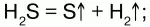
3) вступает в реакцию с галогенами:
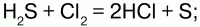
4) взаимодействует с окислителями:

5) серебро при взаимодействии с сероводородом темнеет:
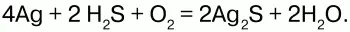
Применение:сероводород используют как химический реактив, а также как сырье для получения серы и серной кислоты.
Сероводородная кислота – слабая кислота. Водный раствор сероводорода.
Сульфиды– средние соли сероводородной кислоты.
Получение сульфидов:
1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS;
2) взаимодействие сводными растворами солей металлов: CuSO4 + H2S = CuS? + H2SO4;
3) сульфиды подвергаются гидролизу:

Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы).
Полисульфиды– соединения с большим содержанием серы, например Na2S2, Na2S5.
Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14).
Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники.
27. Свойства серной кислоты и ее практическое значение
Структура формулы серной кислоты:
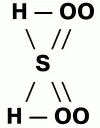
Получение:основным методом производства серной кислоты из SO3 является контактный метод. Вначале получают диоксид серы SO2 (сжигание серы и др.). Самый распространенный способ получения – обжиг серного колчедана FeS2, затем диоксид серы SO2 окисляют в триоксид серы SO3 контактным методом. Полученный три-оксид серы SO3 направляют на стадию поглощения, которую проводят концентрированной серной кислотой. Раствор SO3 в H2SO4 называется олеум. Контактным методом получают 92,5 %-ную серную кислоту. При нитрозном методе H2SO4 получают, окисляя SO2 в сернокислотном растворе, для этого в качестве катализатора используют смесь оксидов азота NO и NO2. Нитрозным методом получают 75 %-ную серную кислоту.
Чтобы приготовить раствор серной кислоты, ее необходимо выливать в воду тонкой струйкой, сильно перемешивая, при этом в воде образуются гидраты и происходит выделение теплоты.
Физические свойства:Серная кислота – бесцветная вязкая жидкость, имеющая температуру плавления 10 °C, температура кипения 296 °C (с разложением на H2Oи SO3). Серная кислота– сильная кислота. Концентрированная серная кислотав большом количестве поглощает пары воды, поэтому ее используют для осушения газов.
Химические свойства.
1. Концентрированная серная кислота является сильным окислителем. Окислительно-восстановительные реакции требуют нагревания, а продуктом реакции в основном является SO2.
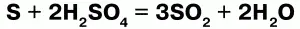
2. С металлами вступает в реакцию по-разному в зависимости от концентрации. Разбавленная серная кислота взаимодействует со всеми металлами, стоящими в ряду напряжений до водорода. Концентрированная серная кислота окисляет все металлы, стоящие в ряду напряжений, и серебро в том числе.
3. Разбавленная серная кислота взаимодействует с основаниями, основными и амфотерными оксидами, солями.
Серная кислота образует два вида солей:средние (сульфаты) и кислые (гидросульфаты).
Применение:серная кислота относится к главным продуктам химической промышленности. Ее используют для изготовления фосфорных и азотных удобрений, искусственных волокон, моющих средств, взрывчатых веществ, лекарственных препаратов. С ее помощью получают другие кислоты, сульфаты, очищают нефтепродукты, применяют как электролит в свинцовых аккумуляторах, подготавливают поверхность металлов для гальванических покрытий.
28. Азот. Сигма– и пи-связи
Азот (N)стоит во 2 периоде, V группе главной подгруппы. Порядковый номер – 7, Ar – 14,008. Строение молекулы::N = N:молекула N2 –самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная. Самая короткая и прочная, соединяющая центры атомов – ?-связь, расположенная на пересечении плоскостей рх– и рz– орбиталей, которые, перекрываясь, образуют 2, более длинные ?-связи, расположенные в 2-х взаимно перпендикулярных плоскостях по отношению друг к другу.
Читать дальшеИнтервал:
Закладка:









