Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Физические свойства: F2 – бесцветный, трудно сжижающийся газ; Br2 – жидкость красно-бурого цвета, легко испаряется, образуя красно-бурые пары; I2 – кристаллическое вещество фиолетового цвета со слабым металлическим блеском, при постепенном нагревании йод сублимируется, превращаясь в пар, минуя жидкое состояние. Бром и йод малорастворимы в воде, хорошо растворяются в органических растворителях – в бензине, бензоле, спирте. Химические свойства:галогены – ярко выраженные неметаллы. Фтор F2 – связь ковалентная неполярная обладает высокой химической активностью, за счет маленького радиуса атома, является сильнейшим окислителем. Фтор реагирует практически со всеми простыми и сложными веществами. Окисляет кислород, образуя фториды кислорода: ОF2 и О2F2. Вступает во взаимодействие даже с некоторыми инертными газами: 2F2 + Хе = ХеF4.
Не реагирует фтор только с гелием, неоном и аргоном . Водородное соединение фтора – НF (фтороводород) при растворении в воде образует плавиковую кислоту. Бром и йод тоже вступают в реакции со многими соединениями, особенно с металлами, которые сгорают в них и образуются соответствующие соли. Металлы при этом отдают электроны, а галогены их принимают, являясь окислителями. При растворении в воде дает бромную воду. Молекулы их также двухатомные, ковалентные неполярные, но они менее активны, чем фтор, что объясняется большим радиусом атома у брома и йода, чем у фтора. Все галогены – активные окислители, что проявляется при взаимодействии их с различными сложными веществами – смешивание сероводородной воды с раствором брома:
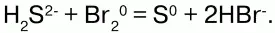
Бром с нулевой степенью окисления окисляет серу (-2) до 0, сам при этом восстанавливаясь до -1.
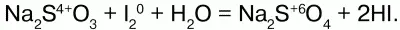
Йод (0) окисляет серу (+4) до +6, восстанавливаясь до -1.
Галогены нашли широкое применение в химической промышленности: фтор используют в синтезе полимеров – фторопластов, пластмассы, стойкой к химическим воздействиям (тефлон), смазочных веществ, жидкостей для холодильников (фреоны). Бром используется в изготовлении лекарственных препаратов, некоторых красителей; йод широко используется в медицине – 10 %-ный раствор йода в спирте – как антисептическое, дезинфицирующее средство, йод входит в состав некоторых фармацевтических препаратов. Также бром и йод используются при различных синтезах и анализах веществ.
22. Общая характеристика подгруппы кислорода
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделле-ва, включающая следующие элементы:
1) кислород – О;
2) сера – S;
3) селен – Se;
4) теллур – Te;
5) полоний – Po (радиоактивный элемент).
Номер группы указывает на максимальную валентность элементов, стоящих в этой группе. Общая электронная формула халькогенов: ns2np4– на внешнем валентном уровне у всех элементов имеется 6 электронов, которые редко отдают и чаще принимают 2 недостающих до завершения уровня электрона. Наличие одинакового валентного уровня обуславливает химическое сходство халькогенов. Характерные степени окисления: -1; -2; 0; +1; +2; +4; +6. Кислород проявляет только -1 – в пероксидах; -2 – в оксидах; 0 – в свободном состоянии; +1 и +2 – во фторидах – О2F2, ОF2 т. к. у него нет d-под-уровня и электроны разъединяться не могут, и валентность всегда – 2; S – все, кроме +1 и -1. У серы появляется d-подуровень и электроны с 3р и с 3s в возбужденном состоянии могут разъединиться и уйти на d-подуровень. В невозбужденном состоянии валентность серы – 2 – в SО, 4 – в SО2, 6 – в SО3. Se +2; +4; +6, Te +4; +6, Po +2; -2. Валентности у селена, теллура и полония также 2, 4, 6. Значения степеней окисления отражены в электронном строении элементов: О – 2s22p4; S – 3s23p4; Se – 4s24p4; Te – 5s25p4; Po – 6s26p4. Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R: H2О, H2S, H2Sе, H2Те – хальководороды.Водород в этих соединениях может быть замещен на ионы металлов. Степень окисления всех халькогенов в соединении с водородом -2 и валентность тоже 2. При растворении хальководородов в воде образуются соответствующие кислоты. Эти кислоты – восстановители. Сила этих кислот сверху вниз возрастает, т. к. уменьшается энергия связи и способствует активной диссоциации. Кислородные соединения халькогенов отвечают формуле: RО2 и RО3 – кислотные оксиды. При растворении этих оксидов в воде они образуют соответствующие кислоты: Н2RО3 и Н2RO4. В направлении сверху вниз сила этих кислот убывает. Н2RО3 – кислоты-восстановители, Н2RO4 – окислители.
23. Кислород и его свойства
Кислород (О)стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s2 2s22p4 . Число электронов на внешнем уровне – 6. Кислород может принять 2 электрона и в редких случаях отдать. Валентность кислорода 2, степень окисления -2.
Физические свойства:кислород (О2 )– бесцветный газ, без запаха и вкуса; в воде малорастворим, немного тяжелее воздуха. При -183 °C и 101,325 Па кислород сжижается, приобретая голубоватый цвет. Строение молекулы:молекула кислорода двухатомна, в обычных условиях прочная, обладает магнитными свойствами. Связь в молекуле ковалентная неполярная. Кислород имеет аллотропную модификацию – озон(О3 ) –более сильный окислитель, чем кислород.
Химические свойства:до завершения энергетического уровня кислороду нужно 2 электрона, которые он принимает проявляя степень окисления -2, но в соединении со фтором кислород ОF2 -2 и О2F2 -1. Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды:

Кислород не реагирует только с платиной. При повышенных и высоких температурах реагирует со многими неметаллами:


Непосредственно кислород не взаимодействует с галогенами. Кислород реагирует со многими сложными веществами:
Читать дальшеИнтервал:
Закладка:









