Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
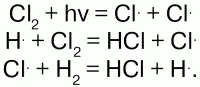
Реакция с Вr происходит при нагревании, с I при сильном нагревании и не полностью, т. к. идет обратная реакция. H восстанавливает многие металлы из их оксидов:
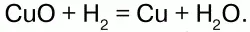
С многими неметаллами H образует газообразные соединения: СН4, SiH4 – силан, Н2S – сероводород и др. Синтезом Н с N получают аммиак:
Особо активен атомарный H. Он реагирует с кислородом без поджигания: 2Н? + О2 = Н2О2. Без нагревания восстанавливает многие неметаллы. С галогенами реагирует быстро, даже в темноте.
Получение:в лаборатории в аппарате Кипа воздействием на него НСl или Н2SО4 с Zn:
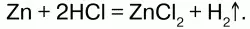
Или электролизом воды с добавлением NаОН.
В промышленности Н получают:
а) конверсией воды:
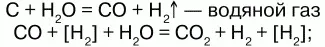
б) конверсией СН4:
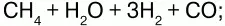
в) кислородной конверсией:
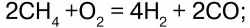
г) нагреванием СН4:
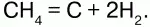
17. Вода
Из оксидов водорода самым распространенным на Земле является вода.Эмпирическая формула – Н2О.Молекулярная масса – 18. Строение молекулы воды(структурная формула):
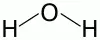
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Физические свойства:вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства:вода незначительно диссоциирует:
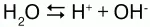
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:

Взаимодействует со многими основными оксидами, металлами:
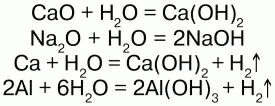
С кислотными оксидами:
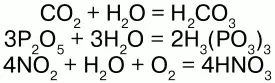
Получение:вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью. Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе:вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О; CuSO4 ? 5Н2О; MgSO4? 7Н2О. Тяжелая вода D2Оотличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D(дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О =1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.
18. Перекись водорода
Пероксид, или перекись водорода– кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства:перекись водорода – бесцветная сиропообразная жидкость, плотность – 1,45 г/см3относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:

по II ступени:
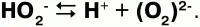
Химические свойства:при взаимодействии концентрированного раствора Н2О2 сгидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 идр.
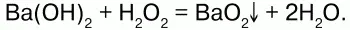
Пероксиды, или перекиси– это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
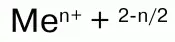
Н2О2 проявляет окислительно-восстановительные свойства: окисляет вещества стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстанавливает вещества у которых Е° больше 0,682 В. Окислительно-восстановительные свойства Н2О2объясняются тем, что степень окисления -1 у атомов кислорода имеет промежуточное значение между степенями окисления -2 и 0. Более характерны для него окислительные свойства.
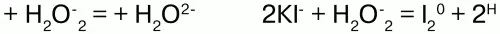
Н2О2 здесь выступает окислителем.
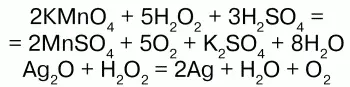
В этих случаях пероксид водорода является восстановителем.
Соли H2O2 –пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
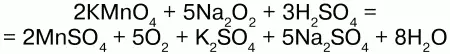
Здесь Na2O2 – восстановитель.
Читать дальшеИнтервал:
Закладка:









