Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
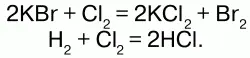
То есть из двух молекул бромида калия и одной молекулы хлора (т. е. в общем из трех молекул) образовалось 2 молекулы хлорида калия и одна молекула брома (т. е. образовалось три молекулы), 3 = 3. Из одной молекулы водорода и одной молекулы хлора – 2 молекулы хлороводорода. А масса веществ до и после реакции не претерпевает изменений, т. к. атомы имеют постоянную массу. Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. В 1789 г.независимо от Ломоносова этот же закон изложил французский ученый и химик Лавуазье. Он также экспериментальным путем получил неопровержимое доказательство закона, проведя опыты с многими реакциями. Закон сохранения массы веществ Ломоносов связывал с сохранением энергии. Он рассматривал эти законы с точки зрения всеобщего закона природы. Закон сохранения массы веществ и закон сохранения энергии – единые законы природы – законы вечной материи и ее движения. Взаимосвязь массы и энергии выражается уравнением Энштейна: Е = mc2, где Е – энергия, m – масса, и с – скорость света в вакууме. Значение закона сохранения массы веществ.Закон сохранения массы веществ позволяет правильно составить уравнение химических реакций, является опорой для осуществления расчетов по химическим уравнениям, позволяет сформулировать представление о всеобщем равновесии материи.
4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
Эквивалент– такое количество вещества (элемента), которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Это величина безразмерная, непостоянная, зависит от ряда факторов: валентности, реакций, в которых участвует вещество:
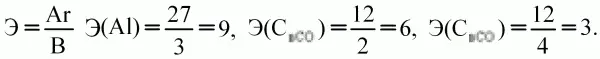
В окислительно-восстановительных реакциях:
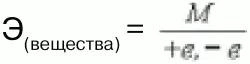
Эквивалент в реакциях нейтрализации зависит от того, какая соль получается в результате реакции (средняя или основная).
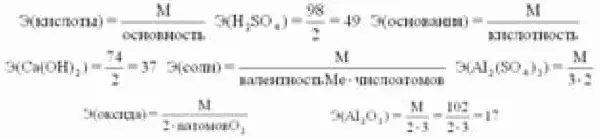
или

Закон эквивалентов открыт в 1873 году Рихтером: вещества взаимодействуют друг сдругом, а также получаются в массовых количествах, пропорциональных их эквивалентам.
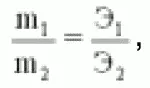
где m1 и m2 – массы веществ, Э – эквиваленты.
Неорганические вещества делятся на простые(металлы и неметаллы) и сложные(оксиды, основания, кислоты, соли).
Оксиды– сложные вещества, состоящие из двух элементов, один из которых кислород, бывают несолеобразующие (N2O) и солеобразующие (основные (К2О), кислотные (SО2), амфотерные (Al2O3). Основания– электролиты, которые при диссоциации образуют только гидроксид-ионы, бывают растворимые (щелочи: NаОН, Ва(ОН)2), нерастворимые (Fe(OH)2), амфотерные (Аl(ОН)3). Кислоты– электролиты, которые при диссоциации образуют катионы водорода, бывают сильные (Н2S O4, НNO3), слабые (НBr), одноосновные (НСl), многоосновные (Н2СО3, Н3РО4), кислородосодержащие (Н2SO4, НСlО), бескислородные (НI, НСN). Соли– электролиты, при диссоциации которых образуются катионы металлов или катион аммония NН4, анионы кислотных остатков, бывают средние (К2SO4, Сu(NO3)2), кислые (КНSO4, NаНСО3), основные (СuОНСl, FeOHSO4), двойные (КМnO4, СаZnO2), комплексные (К4[Fe(CN)6]), растворимые (NаСl, К2SO4) и нерастворимые (ВаSO4, АgСl).
5. Периодическая система элементов Д.И. Менделеева
Периодический закон был открыт в 1869 году Д.И. Менделеевым. Им же была создана классификация химических элементов, выраженная в форме периодической системы. До Менделеева были предприняты попытки классификации и систематизации элементов, но неудачные. Менделеев был уверен, что между элементами существует закономерная связь. Он доказал это, расположив элементы по возрастанию, взяв за основу атомный вес, и обнаружил, что элементы, имеющие аналогичные химические свойства, встречаются через одинаковые интервалы. Эта закономерность была выражена в периодическом законе:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
При анализе периодической системы Менделеева было обнаружено:
Свойства химических элементов по мере возрастания атомного веса не изменяются бесконечно, а имеют периодический характер.
В таблице Менделеева существуют периоды и группы:
Периоды– это ряды элементов, в которых свойства элементов меняются последовательно. В таблице Менделеева 3 малых и 4 больших периода. Группы– это ряды элементов, обладающих сходными свойствами. В таблице Менделеева 8 групп.
Наибольшая валентность каждой группы по кислороду соответствует номеру группы, за некоторыми исключениями. Элементы первой группы образуют оксиды с общей формулой – R2O, второй – RO, третьей – R2O3и т. д.
Группы делятся на подгруппы: главную и побочную.
Значение периодической системы Менделеева.
Периодическая система элементов явилась первой естественной классификацией химических элементов, показавшей, что они взаимосвязаны друг с другом, а также послужила дальнейшим исследованиям.
Когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Как, например, три элемента 4-го периода. Предположительно элементы назывались экабор (его свойства должны напоминать бор), экаалюминий, экасилициум. В течение 15 лет предсказания Менделеева подтвердились. Французский химик Лекок де Буабодраноткрыл галлий, обладающий всеми свойствами экаалюминия, Л.Ф. Нильсоноткрыл скандий, и К.А. Винклероткрыл элемент германий, имеющий свойства экасилиция.
Открытие Ga, Sc, Ge – доказательство существования периодического закона. Большое значение имела периодическая система и при установлении валентности и атомных масс некоторых элементов, исправив некоторые из них. На основе периодического закона в настоящее время созданы трансурановые элементы.
Читать дальшеИнтервал:
Закладка:









