М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
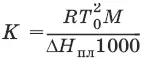
Т 0 2 – температура замерзания растворителя; М – молекулярная масса растворителя, ΔН пл– мольная теплота плавления растворителя.
Температура кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению.
Повышение температуры кипения растворов нелетучих веществ Δ Т К= Т к– Т к 0 пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ΔТ кип= ЕС m, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль,
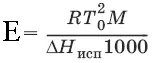
Осмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению π (Па).
Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: π = CRT.
Изотонические растворы – два раствора с одинаковым осмотическим давлением (π 1= π 2).
Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (π 1 > π 2).
Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (π 1 < π 2).
3.3. Растворы электролитов
Степень диссоциации α – отношение числа молекул n, распавшихся на ионы, к общему числу молекул N:
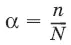
Изотонический коэффициент i Ван-Гоффа – отношение фактического числа частиц в растворе электролита к числу частиц этого раствора без учета диссоциации.
Если из N молекул продиссоциировало n, причем каждая молекула распалась на ν ионов, то
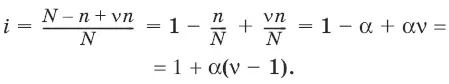
Для неэлектролитов i = 1.
Для электролитов 1 < i ≤ ν.
3.4. Коллигативные свойства растворов электролитов:
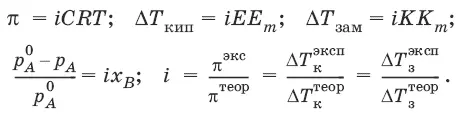
1. Электролиты в растворах распадаются на ионы – диссоциируют.
2. Диссоциация является обратимым равновесным процессом.
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0,7), средней силы (0,3 < α < 0,7) и слабые (α ≤ 0,3).
Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:

Для бинарного электролита:
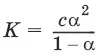
Для разбавленных растворов можно считать, что (1 – α) = 1 и К ≈ α 2С.
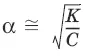
– закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f , который является мерой отклонения свойств реального раствора от идеального:
Для бинарного электролита:
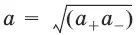
– средняя активность электролита;
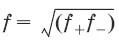
– средний коэффициент активности.
Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ½, где z – заряд иона, для которого рассчитывается коэффициент активности;
I – ионная сила раствора I = 0,5Σ(С ir i 2).
4. Электропроводность растворов электролитов
Проводники I рода – металлы и их расплавы, в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости.
Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см 2:
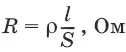
Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток.
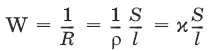
Удельная электропроводность χ(к) – электропроводность проводника I рода длиной 1 м с площадью поперечного сечения 1 м 2или электропроводность 1 м 3(1 см 3) раствора электролита (проводника II рода) при расстоянии между электродами 1 м (1 см) и площади электродов 1 м 2(1 см 2).
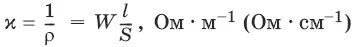
Молярная электропроводность раствора) λ – электропроводность раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





