Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли С жидкой дисперсной фазой (Г 1- Ж 2), а пыль и дым — аэрозоли с твердой дисперсной фазой (Г 1- Т 2); пыль образуется при диспергировании веществ, а дым — при конденсации летучих веществ.
Пены — это дисперсия газа в жидкости (Ж 1- Г 2), причем в пенах жидкость вырождается до тонких пленок, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, нерастворяющей ее жидкости (Ж 1- Ж 2). Низкодисперсные системы твердых частиц в жидкостях (Ж 1- Т 2) называют суспензиями, или взвесями, а предельно-высокодисперсные — коллоидными растворами, или золями, часто лиозолями, чтобы подчеркнуть, что дисперсионной средой является жидкость (от греч. «лиос» — жидкость).
- 299 -
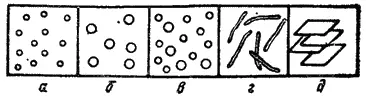
Рис. 88. Свободнодисперсные системы: корпускулярно- (а—в), волокнисто- (г)и пленочно-дисперсные (д); а, 6 — монодисперсные; в — полидисперсная система.
Если дисперсионной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость — органозолями.
В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые тела. К системам Т 1- Г 2(твердые пены) относятся пенопласты, пенобетон, пемза, шлак, металлы с включением газов. Как своеобразные твердые пены можно рассматривать и хлебобулочные изделия. В твердых пенах газ находится в виде отдельных замкнутых ячеек, разделенных дисперсионной средой. Примером системы Т 1- Ж 2является натуральный жемчуг, представляющий собой карбонат кальция, в котором коллоидно-диспергирована вода.
Большое практическое значение имеют дисперсные системы типа Т 1- Т 2. К ним относятся важнейшие строительные материалы (например, бетон), а также металлокерамические композиции (керметы, стр. 639) и ситаллы (стр. 500),
К дисперсным системам типа Т 1- Т 2относятся также некоторые сплавы, цветные стекла, эмали, ряд минералов, в частности некоторые драгоценные и полудрагоценные камни, многие изверженные горные породы, в которых при застывании магмы выделились кристаллы.
Цветные стекла образуются в результате диспергирования в силикатном стекле примесей металлов или их оксидов, придающих стеклу окраску. Например, рубиновое стекло содержит 0,01—0,1% золота с размером частиц 4—30 мкм. Условия получения ярко-красных рубиновых и других окрашенных стекол изучались еще М. В. Ломоносовым. Эмали — это силикатные стекла с включениями пигментов ( SnO 2, TiO 2, ZrO 2), придающих эмалям непрозрачность и окраску. Драгоценные и полудрагоценные камни часто представляют собой оксиды металлов, диспергированные в глиноземе или кварце (например, рубин — это Cr 2O 3, диспергированный в Al 2O 3).
Дисперсные системы могут быть свободнодисперсными (рис. 88) и связнодисперсными (рис. 89, а — б) в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, лиозоля, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы — твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями.
- 300 -
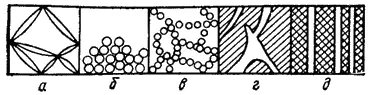
Рис. 89. Связнодисперсные (а — в) и капиллярнодисперсные (г, д) системы: гель (а), коагулят с плотной (б) и рыхлой — «арочной» (в) структурой.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразовапием (или желатинированием). Сильно вытянутая и пленочно-листочковая форма дисперсных частиц повышает вероятность контактов между ними и благоприятствует образованию гелей при малой концентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии (пасты), пены — примеры связнодисперсных систем. Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы (рис. 89, г, д). К ним относятся, например, древесина, разнообразные мембраны и диафрагмы, кожа, бумага, картон, ткани.
106. Состояние вещества на границе раздела фаз.
Все жидкости и твердые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, С паром, другой жидкостью или твердым телом. Свойства вещества в этой межфазной поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объема фазы. Внутри объема чистого вещества в твердом, жидком или Газообразном состоянии любая молекула окружена себе подобными молекулами. В пограничном слое молекулы находятся во взаимодействии или с разным числом молекул (например, на границе жидкости или твердого тела с их паром), или с молекулами различной химической природы (например, на границе двух взаимно малорастворимых жидкостей). Чем больше различие в напряженности межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемая поверхностной энергией.
Работу, затрачиваемую на изотермическое и обратимое образование единицы новой поверхности раздела фаз и равную изменению энергии Гиббса в соответствующем процессе (см. § 67), называют удельной свободной поверхностной энергией (σ). В случае границы двух конденсированных фаз эту величину называют пограничным, а для границы жидкости с ее парами — поверхностным натяжением.
Поверхностное и пограничное натяжение выражаются в единицах работы, деленных на единицы площади (напомним, что 1 эрг = 1 дин·см = 10 -7Дж; 1 м 2= 10 4см 2):
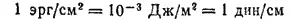
- 301 -
Значение σ зависит от природы соприкасающихся фаз, температуры и добавок растворенных веществ.
Для большинства чистых жидкостей на границе с воздухом, насыщенным их парами (малополярной средой) поверхностное натяжение находится в пределах 1-5·10 -2Дж/м 2, а для сильно полярной жидкости — воды — при 20°C, σ=7.275·10 -2Дж/м 2. С повышением температуры величина а уменьшается (ослабление межмолекулярного взаимодействия), и при критической температуре, когда исчезает граница между жидкостью и паром, σ=0
Читать дальшеИнтервал:
Закладка:








