Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
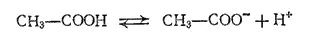
С основаниями эти кислоты образуют соли:
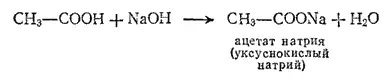
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимому гидролизу. В зависимости от числа карбоксильных групп в молекуле, карбоновые кислоты подразделяются на одноосновные, двухосновные и т. д.
Карбоновые кислоты, как и неорганические кислоты, со спиртами образуют сложные эфиры (см. § 173), в виде которых часто встречаются в природных продуктах.
- 472 -
Уксусная кислота CH 3-COOH (безводная) — жидкость с острым раздражающим запахом (темп. кип. 118,1°C); при +16,7°C застывает в кристаллическую массу, по виду напоминающую лед (100 %-ная, или «ледяная» уксусная кислота). Смешивается с водой в любых соотношениях. Широко применяется как приправа к пище и консервирующее средство. В продажу поступает пищевая уксусная кислота в виде 80% (уксусная эссенция) и 9% (уксус) водного раствора. Давно известен натуральный, или винный, уксус — продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина (в результате микробиологического окисления содержащегося в вине этилового спирта). Уксусная кислота используется также во многих синтезах и как растворитель. Теперь и пищевую и техническую уксусную кислоту получают преимущественно синтезом из ацетилена — присоединением к нему воды по реакции Кучерова и окислением образующегося уксусного альдегида.
Высшие жирные кислоты. К ним относятся предельные и непредельные карбоновые кислоты с открытой цепью атомов углерода, содержащие 16, 18 и более С-атомов; такого рода кислоты входят в состав природных жиров (см. § 173). Важнейшими являются предельные кислоты пальмитиновая C 15H 31COOH, или CH 3(CH 2) 14COOH, и стеариновая C 17H 35COOH, или CH 3(CH 2) 16COOH, а также непредельная C 17H 33COOH, или CH 3(CH 2) 7=CH(CH 2) 7COOH - олеиновая кислота. Высшие предельные кислоты — воскообразные вещества, непредельные — жидкости (напоминающие растительное масло). Натриевые и калиевые соли высших жирных кислот называются мылами (например, C 17H 35COONa — стеарат натрия, C 15H 31COOK — пальмитат калия и т. д.). Натриевые мыла — твердые, калиевые — жидкие.
Бензойная кислота C 6H 5-COOH или 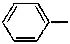 , простейшая одноосновная кислота ароматического ряда. Бесцветные кристаллы (пластинки) (темп, плавл. 121,5°C). Антисептик. Применяется для консервирования пищевых продуктов, а также во многих органических синтезах.
, простейшая одноосновная кислота ароматического ряда. Бесцветные кристаллы (пластинки) (темп, плавл. 121,5°C). Антисептик. Применяется для консервирования пищевых продуктов, а также во многих органических синтезах.
Щавелевая кислота НООС—СООН — простейшая двухосновная карбоновая кислота. Кристаллическое вещество (безводная — темп, плавл. 189°C; дигидрат C 2H 2O 4·2H 2O - темп, плавл. 101.5°C); растворяется в воде; ядовита. В виде кислой калиевой соли содержится во многих растениях. Применяется при крашении тканей.
Терефталевая кислота HOOC-C 6H 4-COOH. Двухосновная карбоновая кислота ароматического ряда. Ее структурная формула:
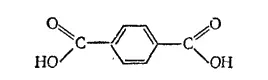
- 473 -
Из терефталевой кислоты и этиленгликоля (см. § 169) получают синтетическое волокно лавсан (см. § 177).
Молочная кислота 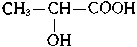 может служить примером соединений со смешанными функциями — проявляет свойства кислоты и спирта (спиртокислота). Она образуется при молочнокислом брожении сахаристых веществ, вызываемом особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
может служить примером соединений со смешанными функциями — проявляет свойства кислоты и спирта (спиртокислота). Она образуется при молочнокислом брожении сахаристых веществ, вызываемом особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота HO-C 6H 4-COOH — аналог молочной кислоты в ароматическом ряду. Имеет строение:
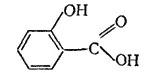
Относится к соединениям со смешанными функциями — проявляет свойства кислоты и фенола (фенолокислота). Антисептик. Используется (особенно ее соли и эфиры) как лекарственное вещество, а также во многих синтезах.
173. Сложные эфиры карбоновых кислот. Жиры.
Продукты взаимодействия карбоновых кислот со спиртами или фенолами представляют собой сложные эфиры. Например:
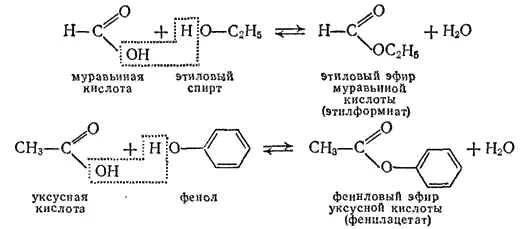
Реакция образования сложного эфира из кислоты и спирта (или фенола) называется реакцией этерификации. Она катализируется ионами водорода и поэтому ускоряется в присутствий минеральных кислот.
Сложные эфиры нерастворимы (или почти нерастворимы) в воде,но растворяются в органических растворителях. Растворы их не проводят электрического тока.
Сложные эфиры, в отличие от простых, с большей или меньшей скоростью расщепляются водой — подвергаются гидролизу с образованием вновь кислоты и спирта. Поэтому, как показанй в схемах приведенных выше реакций, процесс этерификации обратим и доходит до состояния динамического равновесия.
- 474 -
Ионы водорода, как и всякий катализатор (см. § 60), ускоряют протекание не только реакции этерификации, но и обратной ей реакции гидролиза; таким образом в присутствии минеральной кислоты быстрее достигается равновесие в процессе этерификации.
Гидролиз сложных эфиров усиливается гидроксид-ионами. При нагревании со щелочами сложные эфиры расщепляются с образованием спирта и соли кислоты;
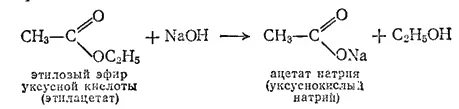
Реакция щелочного гидролиза сложных эфиров называется реакцией омыления.
Многие сложные эфиры карбоновых кислот и предельных спиртов имеют приятный запах и часто встречаются в растениях, придавая аромат цветам, запах плодам и ягодам. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии. Уксусноизоамиловый эфир CH 3COOC 5H 11(грушевая эссенция) применяется как растворитель целлулоида и других пластмасс.
Жиры. Природные животные и растительные жиры (последние обычно называют маслами) представляют собой смеси сложных эфиров, образованных высшими жирными кислотами (см. § 172) и трехатомным спиртом глицерином. Приведем схему образования эфира глицерина и стеариновой кислоты:
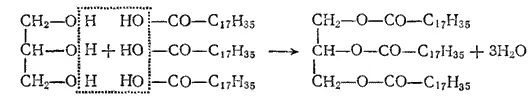
В состав твердых жиров входят главным образом эфиры предельных (пальмитиновой и стеариновой) кислот, а в состав жидких растительных масел — эфиры непредельной (олеиновой) кислоты. При действии водорода (в присутствии никеля в качестве катализатора) жидкие жиры превращаются в твердые вследствие присоединения водорода по месту двойной связи между атомами углерода в этерифицированных молекулах непредельной кислоты. Такой процесс называют гидрогенизацией, или отверждением жиров и используют, например, для получения из растительных масел пищевого маргарина.
Читать дальшеИнтервал:
Закладка:








