Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Из сказанного следует, что формула бензола в виде цикла с чередующимися двойными и простыми связями (формула Кекуле) неточно выражает природу связей между атомами углерода в бензольном ядре. В соответствии с этой формулой в бензоле должно быть три локализованных π-связи, т. е. три пары π-электронов, каждая из которых фиксирована между двумя атомами углерода — схема (1); если обозначить эти π-электроны точками, то строение бензола следует представить схемой (2);
- 462 -
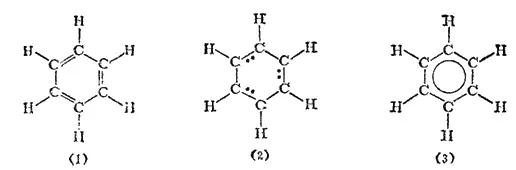
Однако опыт показывает, что в кольце бензола нет обычных двойных связей, чередующихся с простыми, и что все связи между С-атомами в бензоле равноценны. Длина каждой из них (0,140 нм) имеет промежуточное значение по сравнению с длиной простой связи C-C (0.154 нм) и этиленовой двойной связи C=C (0.134 нм) в других (неароматических) органических соединениях.
Каждый из атомов углерода в кольце бензола находится в состоянии sp 2-гибридизации и затрачивает по три валентных электрона на образование σ-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомов углерода и все σ-связи C-C и C-H лежат в одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки («гантели») и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких p-облаков перекрывается над и под плоскостью кольца с р-электронньши облаками двух соседних атомов углерода. Это показано на рис. 132, а и, в проекции, на рис. 132,б. Плотность облаков π-электронов в бензоле равномерно распределена между всеми связями C-C. Иначе говоря, шесть π-электронов обобщены всеми углеродными атомами кольца и образуют единое кольцевое облако (ароматический электронный секстет). Так объясняется равноценность (выравненность) ароматических связей, обусловливающих характерные (ароматические) свойства бензольного ядра. Равномерное распределение облака π-электронов и выравненность связей в бензоле иногда изображают формулой (3) (стр. 462).
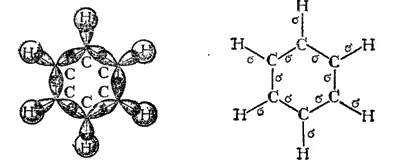
Рис. 131. Схема образования σ-связей в молекуле бензола.
- 463 -
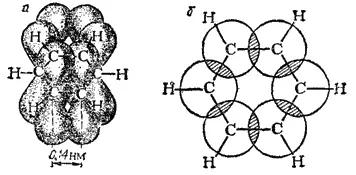
Рис. 132. Схема перекрывания π-электронных облаков в молекуле бензола.
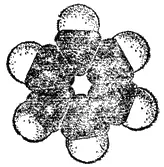
Рис. 133. Сегментовая модель молекулы бензола.
Соответственно, вместо общепринятого символа бензольного ядра в виде шестиугольника с чередующимися двойными и простыми связями, отвечающего формуле Кекуле (1а), бензол изображают шестиугольником с кружочком внутри (3а):

На рис. 133 представлена сегментовая модель молекулы бензола.
С точки зрения метода наложения валентных схем структуру молекулы бензола, представленную формулой (3), следует рассматривать как промежуточную между двумя возможными структурами бензола, выражаемыми формулами Кекуле:
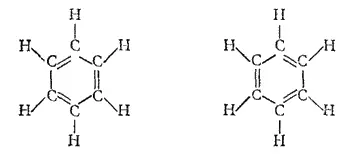
Поскольку в молекуле бензола три электронные пары являются общими для всех шести атомов углерода бензольного кольца, образуемые ими связи — шестицентровые (см, § 44).
168. Галогенпроизводные углеводородов.
Галогенпроизводными называют соединения, которые можно рассматривать как продукты замещения одного или нескольких атомов водорода в молекуле углеводорода атомами галогенов. Ниже приведены примеры соединений этого класса.
Метилендихлорид CH 2Cl 2(хлористый метилен, дихлорметан) - жидкость (темп. кип. 40,1 °C); применяется как растворитель.
- 464 -
Хлороформ CHCl 3(трихлорметан) - жидкость (темп. кип. 61,2°C); применяется для наркоза при хирургических операциях и как растворитель.
Четыреххлористый углерод CCl 4(татрахлорметан) - тяжелая негорючая жидкость (темп. кип. 76,8°C); применяется как растворитель при извлечении жиров и масел из растений, для удаления Жировых пятен с тканей, в огнетушителях.
Дифтордихлорлетан CF 2Cl 2(фреон-12) - жидкость с температурой кипения 29,8°C. Не ядовит, не реагирует при комнатной температуре с металлами. При его испарении поглощается большое количество теплоты. Применяется (как и другие фреоны — полифторхлоруглеводороды) в холодильных устройствах, а также как растворитель для образования аэрозолей.
Винилхлорид CH 2=CH-Cl (хлористый винил) — производное этилена. Бесцветный газ. Получается присоединением хлороводорода к ацетилену. Легко полимеризуется, применяется для получения поливинилхлорида (стр. 486).
Тетрафторэтилен CF 2=CF 2— бесцветный газ. Получается пиролизом фреона-22(CHF 2Cl). Применяется для получения фторопласта (стр. 486).
Некоторые галогенпроизводные углеводородов входят в состав ядохимикатов — химических средств для борьбы с вредными насекомыми (инсектициды) и грибками, поражающими растения (фунгициды).
169. Спирты и фенолы.
Спирты — производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода заменены гидроксильными группами. Так, метиловый спирт (метанол) CH 3-OH представляет собой гидроксильное производное метана CH 4, этиловый спирт (этанол) CH 3-CH 2-OH — производное этана CH 3-CH 3. Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами. Так, фенол C 6H 6-OH (или 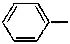 ) — производное бензола C 6H 6— простейший представитель класса фенолов.
) — производное бензола C 6H 6— простейший представитель класса фенолов.
Подобно молекулам воды (см. § 70), молекулы низших спиртов связываются между собой водородными связями. Поэтому они представляют собой ассоциированные жидкости и имеют более высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие органические вещества с таким же составом и молекулярной массой, но не содержащие гидроксильных групп.
- 465 -
Фенолы при обычных условиях находятся, как правило, в кристаллическом состоянии.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. Так, при действии на спирт щелочного металла этот водород вытесняется металлом и получаются твердые, растворимые в спирте соединения, называемые алкоголятами, например:
Читать дальшеИнтервал:
Закладка:








