Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Классы органических веществ весьма разнообразны; ниже вкратце рассмотрены лишь важнейшие из них.
164. Предельные (насыщенные) углеводороды.
Простейший представитель класса предельных углеводородов — метан CH 4. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Температура его кипения равна -161,5°C, температура затвердевания -182,5°C.
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
Молекула метана характеризуется сравнительно большой прочностью. При обычных условиях метан активно (со взрывом) реагирует с фтором, очень медленно взаимодействует с хлором и почти не реагирует с бромом. Реакция с хлором или бромом ускоряется под действием света, а также при нагревании и заключается в последовательном замещении атомов водорода атомами галогена с образованием галогенпроизводных, например:
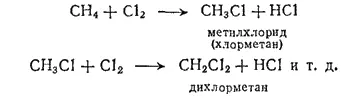
Метан горит синеватым или почти бесцветным пламенем, выделяя большое количество теплоты (879 кДж/моль). Однако при обычных условиях он не окисляется раствором перманганата калия (фиолетовая окраска раствора KMnO 4при контакте с предельными углеводородами не исчезает).
- 453 -
Как уже было указано, метан — первый представитель гомологического ряда предельных или насыщенных углеводородов:

В молекулах этих соединений все связи между атомами углерода простые (ординарные), атомы углерода максимально, до предела «насыщены» водородом. Состав любого из гомологов отвечает общей формуле C nH 2n+2(где n — число атомов углерода); эта закономерность дает возможность написать формулу состава для предельного углеводорода с любым числом С-атомов, например C 18H 28(октадекан), C 100H 202(гектан).
Состав одновалентных радикалов, получаемых отнятием атома водорода от молекулы предельного углеводорода, выражает формула C nH 2n+1-. Названия их образуются заменой окончания -ан в названии углеводорода окончанием -ил. Так, от метана производится метил CH 3-, от этана — этил C 2H 5-, от пропана — пропил C 3H 7- и т. д.
Как и в других гомологических рядах, в ряду метана проявляется всеобщий закон природы — закон перехода количественных изменений в качественные. Изменение состава молекулы на группу CH 2каждый раз приводит к новому веществу, которое хотя и имеет много общего с соседними членами ряда, но вместе с тем по некоторым свойствам отличается от них. Различие гомологов ясно проявляется в их физических свойствах. Низшие члены ряда предельных углеводородов (от CH 4до C 4H 10) - газы; средние члены (от C 5H 12до C 16H 34) при температуре до 20°C — жидкости, остальные при обычных условиях находятся в твердом состоянии. Во всех случаях температуры кипения и затвердевания тем выше, чем больше молекулярная масса углеводорода.
В то же время предельные углеводороды в химическом отношении подобны метану. Они весьма инертны, вступают лишь в реакции замещения водорода, протекающие крайне медленно, и Не обесцвечивают на холоду растворы брома и перманганата калия.
Все предельные углеводороды горят и могут быть использованы в качестве топлива. Они входят в состав нефтей и продуктов Их перегонки. При фракционной перегонке нефть разделяют на отличающиеся по температурам кипения фракции («погоны») и получают следующие нефтепродукты:
а) бензины (темп. кип. 40-180°C) содержат углеводороды C 5H 12до C 10H 22при повторной перегонке из них могут быть быделены легкие нефтепродукты, кипящие в более узких пределах: петролейный эфир(40-70°C), авиационный бензин (70—100°C), автомобильный бензин (100—120°C);
б) керосины (темп. кип. 180-270°C) содержат углеводороды от C 10H 22до C 16H 34;
- 454 -
в) соляровые масла (темп. кип. 270-360°C) содержат смеси углеводородов от C 12до C 20из них получают смазочные масла и различные виды дизельного топлива;
г) мазут (нефтяные остатки — до 40-50%) содержит еще более тяжелые (высшие) углеводороды; из мазута получают тяжелые смазочные масла, вазелин, парафин.
Как уже было указано, с увеличением числа С-атомов в молекулах резко возрастает число изомеров предельных углеводородов. Метан CH 4, этан C 2H 6и пропан C 3H 8не имеют изомеров; бутанов C 4H 10существует два:
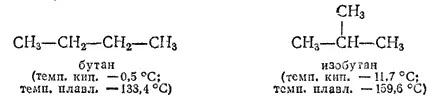
Изомерных пентанов C 5H 12— три, гексанов C 6H 14- пять, гептанов C 7H 16— девять, октанов C 8H 18- 18, нонанов C 9H 20- 35. Все эти углеводороды получены. Деканов C 10H 22может быть 75, а формулу C 15H 32могут иметь уже 4347 изомерных углеводородов. Для высших гомологов пока известны лишь некоторые изомеры, однако принципиальная возможность их существования предсказана и доказана А. М. Бутлеровым; им был осуществлен первый синтез углеводорода с разветвленной цепью — изобутана.
Как отдельные гомологи, так и изомеры отличаются друг от друга не только физическими, но и химическими свойствами. Сильная разветвленность углеродной цепи часто приводит к повышению температур замерзания, и высокое содержание таких углеводородов в бензинах может ограничивать возможность использования последних в зимних условиях.
Различие в химических свойствах сказывается, в частности, на склонности некоторых углеводородов, входящих в состав моторного топлива, к детонации.
Детонация моторного топлива представляет собой чрезвычайно быстрое разложение (взрыв) углеводородов, которое происходит внезапно при сжатии горючей смеси в цилиндре двигателя. Детонация не дает возможности достигнуть высокой степени сжатия горючей смеси*, ведет к излишнему расходу топлива и быстрому износу мотора. Детонационные свойства топлива зависят от строения углеродных цепей в молекулах углеводородов, входящих в его состав. Изомеры с сильно разветвленной цепью детонируют гораздо труднее, чем изомеры с неразветвленной цепью.
* Увеличение степени сжатия повышает мощность двигателя.
- 455 -
Антидетонационные свойства моторного топлива характеризуют так называемым октановым числом (о.ч.). В качестве стандартных образцов для определения октанового числа берут углеводород гептан C 7H 16с неразветвленной цепью атомов, весьма легко детонирующий, и один из изомеров октана (изооктан), с разветвленной цепью атомов, мало склонный к детонации:
Читать дальшеИнтервал:
Закладка:








