Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
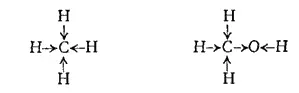
В приведенных структурных формулах стрелками на черточках связей условно показано смещение пар электронов, образующих ковалентную связь, вследствие различной электроотрицательности, атомов. В метане такое смещение в связи H→O невелико, поскольку электроотрицательность углерода (2,5) лишь незначительно превышает электроотрицательность водорода (2,1) табл. 6, стр. 118). При этом молекула метана симметрична. В молекуле же спирта связь O←H значительно поляризована, поскольку кислород (электроотрицательность 3,5) гораздо больше оттягивает на себя электронную пару; поэтому атом водорода, соединенный с атомом кислорода, приобретает большую подвижность, т. е. легче отрывается в виде протона.
В органических молекулах имеет значение также взаимное влияние атомов, не связанных друг с другом непосредственно. Так, в метиловом спирте под влиянием кислорода увеличивается реакционная способность не только атома водорода, связанного с кислородом, но и атомов водорода, непосредственно с кислородом не связанных, а соединенных с углеродом. Благодаря этому метиловый спирт довольно легко окисляется, тогда как метан относительно устойчив к действию окислителей. Это объясняется тем, что кислород гидроксильной группы значительно оттягивает на себя пару электронов в связи 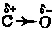 , соединяющей его с углеродом, электроотрицательность которого меньше.
, соединяющей его с углеродом, электроотрицательность которого меньше.
- 449 -
В результате эффективный заряд атома углерода становится более положительным, что вызывает дополнительное смещение пар электронов также и в связях H→C в метиловом спирте, сравнительно с теми же связями в молекуле метана. При действии окислителей атомы Н, связанные с тем же атомом углерода, с которым связана группа ОН, значительно легче, чем в углеводородах, отрываются и соединяются с кислородом, образуя воду. При этом атом углерода, связанный с группой ОН, подвергается дальнейшему окислению (см. § 171).
Взаимное влияние атомов, непосредственно друг с другом не связанных, может передаваться на значительное расстояние по цепи атомов углерода и объясняется смещением плотности электронных облаков во всей молекуле под влиянием имеющихся в ней различных по электроотрицательности атомов или групп. Взаимное влияние может передаваться и через пространство, окружающее молекулу, — в результате перекрывания электронных облаков сближающихся атомов.
163. Классификация органических соединений.
В зависимости от строения углеродных цепей, среди органических соединений выделяют следующие три ряда.
Соединения с открытой цепью атомов углерода, называемые также ациклическими, или соединения жирного ряда. В зависимости от характера связей между атомами углерода, эти соединения подразделяют на предельные (или насыщенные), содержащие в молекулах только простые (ординарные) связи, и непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода.
Соединения с замкнутой цепью атомов углерода, или карбоциклические. Эти соединения в свою очередь подразделяются на:
а) соединения ароматического ряда; они характеризуются наличием в молекулах особой циклической группировки из шести атомов углерода — бензольного ароматического ядра. Эта группировка отличается характером связей между атомами углерода и придает содержащим ее соединениям особые химические свойства, называемые ароматическими свойствами (см. § 167).
б) ациклические соединения — все остальные карбоциклические соединения. Они различаются по числу атомов углерода в цикле и, в зависимости от характера связей между этими атомами, могут быть предельными или непредельными.
Гетероциклические соединения. В молекулах этих соединений имеются циклы, включающие, кроме атомов углерода, также гетероатомы, т. е. атомы других элементов (кислорода, азота, серы и др.).
- 450 -
Соединения каждого из указанных рядов подразделяются на классы.
В рядах ациклических (жирных) и карбоциклических соединений простейшими являются углеводороды, состоящие только из углерода и водорода. Все остальные соединения этих рядов рассматривают как производные углеводородов, образованные замещением одного, двух или нескольких атомов водорода в углеводородной молекуле другими атомами или группами атомов.
Остатки углеводородов, образующиеся при отнятии от их молекул одного, двух или нескольких атомов водорода, называют углеводородными радикалами; одновалентные радикалы обозначают символом R-, двухвалентные — символом -R- (или 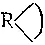 ) трехваленткые — символом —
) трехваленткые — символом — 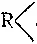 .
.
Атомы или группы атомов, замещающие водород в углеводородной основе, образуют функциональные, или характеристические, группы, обусловливающие общие химические свойства веществ, принадлежащих к одному и тому же классу производных углеводородов. Ниже приведены общие формулы и названия некоторых классов органических соединений (в скобках — формулы и названия функциональных групп).
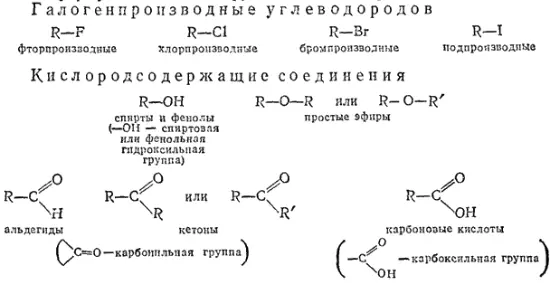
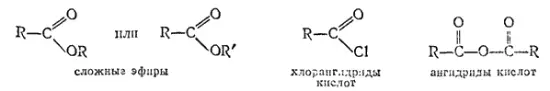
Азотсодержащие соединения
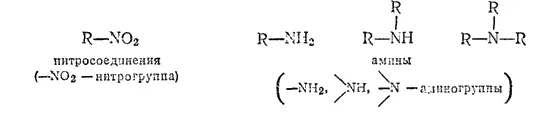
Серусодержащие соединения
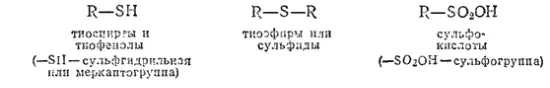
Элементорганические соединения
а) Металлоргапические соединения
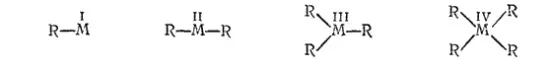
б) Кремкийорганические соединения

Возможны соединения с повторяющимися одинаковыми функциями:
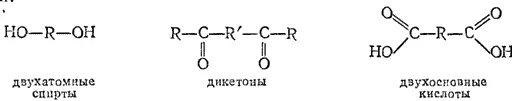
Вещества, в которых имеются различные функциональные группы, называются соединениями со смешанными функциями, например:
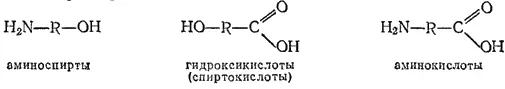
Соединения со смешанными функциями обладают двойственной природой. Например, аминокислоты проявляют одновременно свойства и аминов, и кислот, но и те и другие свойства несколько изменяются вследствие взаимовлияния функциональных групп.
Читать дальшеИнтервал:
Закладка:








