Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кратные (т. е. двойные и тройные) связи при реакциях легко превращаются в простые; тройная вначале переходит в двойную, а последняя — в простую. Это обусловлено их высокой реакционной способностью и имеет место при присоединении каких-либо атомов к паре атомов углерода, связанных кратной связью.
Переход кратных связей в простые объясняется тем, что обычно π-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с p-связями. При образовании π-связей р-электронные облака с параллельными осями перекрываются в значительно меньшей степени, чем электронные облака, перекрывающиеся по оси связи (т. е. гибридные, s-электронные или ориентированные вдоль оси связи р-электронные облака).
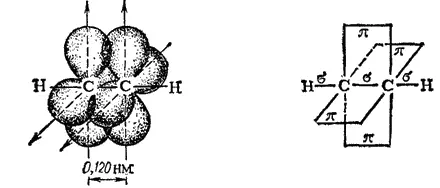
Рис. 127. Схема образования π-связей в молекуле ацетилена.
- 445 -
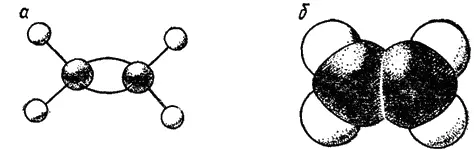
Рис. 128. Модели молекулы этилена: а - шариковая; б — сегментовая.
Кратные связи прочнее простых. Так, энергия разрыва связи C≡C составляет 535 кДж/моль, связи C=C - 423 кДж/моль , а связи C-C только 264 кДж/моль.
Из сказанного следует, что в формулах две черточки из трех в связи C≡C и одна черточка из двух в связи C=C выражают связи менее прочные, чем простая связь C-C.
На рис. 128 и 129 представлены шариковые и сегментовые пространственные модели соединений с двойной (этилен) и с тройной (ацетилен) связями.
4. Теория строения объяснила многочисленные случаи изомерии органических соединений.
Цепи из атомов углерода могут быть неразветвленными или разветвленными:
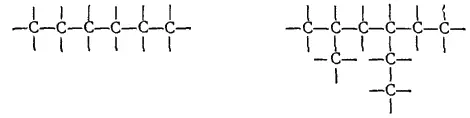
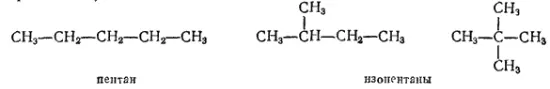
Так, состав C 5H 12имеют три предельных углеводорода (пентана) с различным строением цепей — один с неразветвленной цепью (нормального строения) и два с разветвленной (изостроения):
Состав C 4H 8имеют три непредельных углеводорода (бутилена) - два нормального строения, но изомерные по положению двойной связи и один — изостроения:
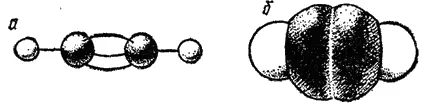
Рис. 129. Модели молекулы ацетилена: а шариковая; б — сегментовая.
- 446 -
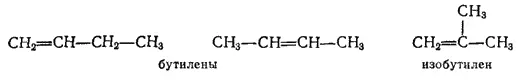
Этим непредельным соединениям изомерны два циклических углеводорода, также имеющие состав C 4H 8и изомерные друг другу по величине цикла:

При одном и том же составе соединения могут различаться по строению вследствие различного положения в углеродной цепи и других, не углеродных, атомов, например:
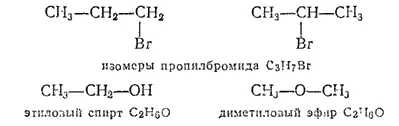
Изомерия может быть обусловлена не только различным порядком соединения атомов. Известно несколько видов пространственной изомерии (стереоизометрии), заключающейся в том, что соответствующие изомеры (стереоизомеры) при одинаковом составе и порядке соединения атомов отличаются различным расположением атомов (или групп атомов) в пространстве.
Так, если в соединении имеется атом углерода, связанный с четырьмя разными атомами или группами атомов (асимметрический атом), то возможны две пространственно-изомерные формы такого соединения. На рис. 130 представлены две тетраэдрические модели молочной кислоты 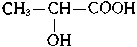 , в которых асимметрический атом углерода (он в формуле помечен звездочкой) находится в центре тетраэдра. Нетрудно заметить, что эти модели невозможно совместить в пространстве: они построены зеркально и отображают пространственную конфигурацию молекул двух различных веществ (в данном примере молочных кислот), отличающихся некоторыми физическими, а главным образом, биологическими свойствами. Такая изомерия называется зеркальной стереоизомерией, а соответствующие изомеры — зеркальными изомерами.
, в которых асимметрический атом углерода (он в формуле помечен звездочкой) находится в центре тетраэдра. Нетрудно заметить, что эти модели невозможно совместить в пространстве: они построены зеркально и отображают пространственную конфигурацию молекул двух различных веществ (в данном примере молочных кислот), отличающихся некоторыми физическими, а главным образом, биологическими свойствами. Такая изомерия называется зеркальной стереоизомерией, а соответствующие изомеры — зеркальными изомерами.
* Наличие такого атома приводит к асимметрии молекул; очевидно, что обе модели на рис. 130 несимметричны - ни через одну из них невозможно провести плоскость симметрии.
- 447 -
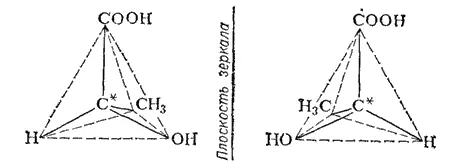
Рис. 130. Тетраэдрические модели молекул зеркальных изомеров молочной кислоты.
Различие в пространственном строении зеркальных изомеров может быть представлено и при помощи структурных формул, в которых показано различное расположение атомных групп при асимметрическом атоме; например, для приведенных на рис. 130 зеркальных изомеров молочной кислоты:
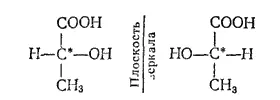
Как уже указано, атомы углерода; соединенные двойной связью, лежат в одной плоскости с четырьмя связями, соединяющими их с другими атомами; углы между направлениями этих связей приблизительно одинаковы (рис. 126). Когда с каждым из атомов углерода при двойной связи соединены различные атомы или группы, возможна так называемая геометрическая стереоизомерия, или цис-транс-изомерия. Примером могут служить пространственные геометрические изомеры дихлорэтилена CHCl≡CHCl:
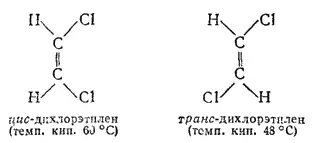
В молекулах одного изомера атомы хлора расположены по одну сторону двойной связи, а в молекулах другого — по разные стороны. Первая конфигурация называется цис-, вторая — транс-конфигурацией. Геометрические изомеры отличаются друг от друга по физическим и химическим свойствам.
- 448 -
Существование их обусловлено тем, что двойная связь исключает возможность свободного вращения соединенных ею атомов вокруг оси связи (такое вращение требует разрыва π-связи; см. рис. 126).
5. Взаимное влияние в молекулах органических веществ проявляют прежде всего атомы, непосредственно связанные друг с другом. В этом случае оно определяется характером химической связи между ними, степенью различия в их относительной электроотрицательности и, следовательно, степенью полярности связи.
Например, если судить по суммарным формулам, то в молекуле метана (CH 4) и в молекуле метилового спирта (CH 4O) все четыре атома водорода должны обладать одинаковыми свойствами. Но, как будет показано дальше, в метиловом спирте один из атомов водорода способен замещаться щелочным металлом, тогда как в метане атомы водорода такой способности не проявляют. Это объясняется тем, что в спирте атом водорода непосредственно связан не с углеродом, а с кислородом
Читать дальшеИнтервал:
Закладка:








