Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Среди органических соединений особенно распространено явление изомерии (см. § 162). Имеется множество соединений углерода, обладающих одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими, а зачастую и химическими свойствами. Например, состав C 2H 6O и, соответственно, молекулярную массу 46,07 имеют два различных изомерных органических вещества: этиловый спирт — жидкость, кипящая при 78.4°C, смешивающаяся с водой в любых соотношениях, и диметиловый эфир — газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химическим свойствам.
Явление изомерии, в частности, обусловливает огромное многообразие органических веществ.
В отличие от минеральных органические вещества своеобразно ведут себя при нагревании. Их температуры плавления не превышают 350-400°C, в большинстве же они плавятся ниже 200—100°C. При нагревании без доступа воздуха органические вещества могут подвергаться глубоким изменениям, в результате которых образуются новые вещества, обладающие совершенно иными свойствами, или же (при температурах порядка 400—600°C) - полному разложению и обугливанию. Если же вести нагревание в присутствии кислорода воздуха или других окислителей, то органические вещества обычно полностью сгорают; при этом входящие в их состав углерод и водород целиком превращаются в диоксид углерода и воду, а азот обычно выделяется в свободном состоянии.
- 438 -
Одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах. В подавляющем большинстве эти связи имеют ярко выраженный ковалентный характер. Поэтому органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом. Время, необходимое для завершения реакций между органическими веществами, обычно измеряется часами, а иногда и днями. Вот почему в органической химии применение различных катализаторов имеет особенно большое значение.
Наконец, следует еще раз подчеркнуть исключительную биологическую роль органических соединений. Многие из них являются непосредственными носителями, участниками или продуктами процессов, протекающих в живых организмах, или же — такие, как ферменты, гормоны, витамины и др. — биологическими катализаторами, инициаторами и регуляторами этих процессов.
162. Теория химического строения органических соединений.
Химическая природа органических соединений, свойства, отличающие их от соединений неорганических, а также их многообразие нашли объяснение в сформулированной Бутлеровым в 1861 г. теории химического строения (см. § 38).
Согласно этой теории, свойства соединений определяются их качественным и количественным составом, химическим строением, т. е. последовательным порядком соединения между собой образующих молекулу атомов, и их взаимным влиянием. Теория строения органических соединений, развитая и дополненная новейшими воззрениями в области химии и физики атомов и молекул, особенно представлениями о пространственной структуре молекул, о природе химических связей и о характере взаимного влияния атомов, составляет теоретическую основу органической химии.
В современной теории строения органических соединений основными являются следующие положения.
- 439 -
1. Все особенности органических соединений определяются, прежде всего, свойствами элемента углерода.
В соответствии с местом, которое углерод занимает в периодической системе, во внешнем электронном слое его атома ( L-оболочка) имеются четыре электрона. Он не проявляет выраженной склонности отдавать или присоединять электроны, занимает в этом отношении промежуточное положение между металлами и неметаллами и характеризуется резко выраженной способностью образовывать ковалентные связи. Структура внешнего электронного слоя атома углерода может быть представлена следующими схемами:
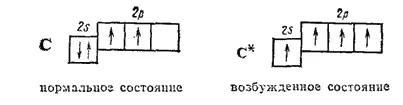
Возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет ковалентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав CH 4. Строение его можно изобразить структурой (а) или электронно-структурной (или электронной) (б) формулами:
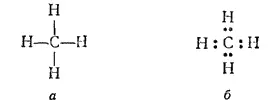
Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку (электронный октет), а атомы водорода — устойчивую двухэлектронную оболочку (электронный дублет).
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве. Атом углерода находится как бы в центре тетраэдра (правильной четырехгранной пирамиды), а четыре соединенных с ним атома (в случае метана — четыре атома водорода) - в вершинах тетраэдра (рис. 120). Углы между направлениями любой пары связей (валентные углы углерода) одинаковы и составляют 109° 28'.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s- и трех р-орбиталей в результате sp 3-гибридизации образуются четыре симметрично расположенные в пространстве гибридные sp 3-орбитали, вытянутые в направлении к вершинам тетраэдра.
- 440 -
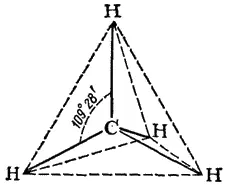
Рис. 120. Тетраэдрическая модель молекулы метана.
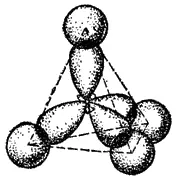
Рис. 121. Схема образования σ-связей в молекуле метана.
В результате перекрывания sp 3-гибридных электронных облаков углерода с электронными облаками других атомов (в метане - с шаровыми облаками 1s-электронов атомов водорода) образуются четыре тетраэдрически направленные ковалентные σ-связи (рис. 121; см. также стр. 131).
Тетраэдрическое строение молекулы метана наглядно выражается ее пространственными моделями — шариковой (рис. 122) или сегментовой (рис. 123). Белые шарики (сегменты) изображают атомы водорода, черные — углерода. Шариковая модель характеризует лишь взаимное пространственное расположение атомов, сегментовая — дает, кроме того, представление об относительных межатомных расстояниях (расстояниях между ядрами). Как показано на рис. 122, структурная формула метана может рассматриваться как проекция его пространственной модели на плоскость чертежа.
Читать дальшеИнтервал:
Закладка:








