Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Реакция образования оксида углерода(II) из простых веществ описывается уравнением:
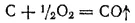
Стандартная энергия Гиббса этой реакции равна -137 кДж/моль, однако стандартная энергия Гиббса реакции
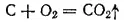
гораздо более отрицательна (-394 кДж/моль). Поэтому при невысоких температурах уголь сгорает до CO 2, а оксид углерода, даже при недостатке кислорода, почти не образуется. Иначе обстоит дело при повышении температуры. По достижении 400-500°C начинает протекать реакция между углем и образовавшимся диоксидом углерода:
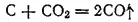
Эта реакция эндотермична и при 298 К изменение стандартной энергии Гиббса при ее протекании положительно (+120 кДж/моль). Однако в ходе превращения происходит двукратное увеличение числа молекул газа и энтропия системы сильно возрастает, так что энтропийное слагаемое энергии Гиббса имеет отрицательный знак. С увеличением температуры это слагаемое начинает преобладать (по абсолютной величине) над энтальпийным членом, в результате чего изменении энергии Гиббса при протекании реакции становится отрицательным. Уже при 800°C степень превращения CO 2в СО достигает 80%.
Рассмотренная реакция между углеродом и CO 2, приводящая к образованию монооксида углерода, осуществляется в очень больших масштабах в доменном процессе (см. § 239), а также в газогенераторах (см. § 159).
В лабораториях оксид углерода(II) обычно получают, прибавляя муравьиную кислоту НСООН к нагретой серной кислоте. Последняя отнимает от муравьиной кислоты воду, выделяя оксид углерода (II):
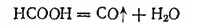
Эта реакция показывает, что оксид углерода (II) можно рассматривать как ангидрид муравьиной кислоты. Хотя муравьиная кислота не может быть получена непосредственно из оксида углерода (II) и воды, соли ее образуются при взаимодействии едких щелочей с оксидом углерода при 150-200°C:
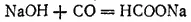
На воздухе оксид углерода горит голубоватым пламенем с выделением большого количества теплоты, превращаясь в CO 2:
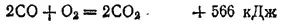
- 430 -
На солнечном свету или в присутствии активного угля (катализатор) оксид углерода непосредственно соединяется с хлором, образуя чрезвычайно ядовитый газ — фосген:
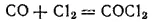
Фосген — важный промышленный продукт. Он применяется при производстве ряда органических и неорганических веществ, например красителей.
Оксид углерода(II) соединяется со многими металлами, образуя карбонилы металлов, например карбонил железа Fe(CO) 5, карбонил никеля Ni(CO) 4. Последние два вещества представляют собой летучие, весьма ядовитые жидкости. Большинство карбонилов металлов—кристаллические вещества. Наибольшее практическое значение имеют карбонилы никеля, кобальта и железа. Они применяются для получения высокочистых металлов (см. § 193), для нанесения металлических покрытий. Кроме того, они служат катализаторами многих важных химических реакций.
Химические связи в молекулах карбонилов металлов образованы по донорно-акцепториому способу за счет неспаренных электронных пар молекулы СО и свободных орбиталей возбужденного атома металла. Например, у возбужденного атома железа имеются пять незанятых валентных орбиталей:
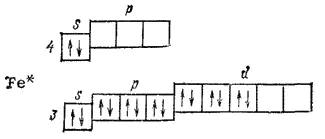
Поэтому молекула карбонила железа имеет состав, отвечающий формуле Fe(CO) 5.
При повышенной температуре оксид углерода(II) — хороший восстановитель, играющий важную роль в металлургии при восстановлении металлов из их оксидов (см. §§ 192 и 239). Он используется также в качестве газообразного топлива (см. § 159) и входит в число исходных веществ в производстве ряда органических соединений.
Оксид углерода(II) очень ядовит и особенно опасен тем, что не имеет запаха; поэтому отравление им может произойти незаметно. Ядовитое действие оксида углерода, известное под названием угара, объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшееся соединение (карбоксигемоглобин) постепенно разрушается, и гемоглобин восстанавливает способность поглощать кислород.
- 431 -
157. Соединения углерода с серой и азотом.
Из соединений углерода с серой и азотом большое практическое значение имеют сероуглерод CS 2и синильная кислота HCN.
Сероуглерод CS 2получается пропусканием паров серы сквозь слой раскаленного угля. Это бесцветная, сильно преломляющая свет летучая жидкость, кипящая при 46°C. При долгом хранении сероуглерод желтеет и приобретает неприятный запах.
Сероуглерод ядовит и легко воспламеняется. В нем хорошо растворяются сера, фосфор, иод, различные жиры и смолистые вещества. Сероуглерод используется для борьбы с вредителями растений и для получения вискозы (стр. 480).
Синильная кислота HCN. При высокой температуре, например в электрической дуге, углерод может непосредственно соединяться с азотом, образуя бесцветный ядовитый газ дициан, молекулярная масса которого соответствует формуле С 2Т 2. По своим химическим свойствам дициан имеет некоторое сходство с галогенами. Подобно им, он образует соединение с водородом HCN, обладающее кислотными свойствами и получившее название циановодорода, или синильной кислоты.
Синильная кислота — бесцветная, очень летучая жидкость, кипящая при 26,7°C и обладающая характерным запахом горького миндаля.
В водном растворе синильная кислота только в незначительной степени диссоциирует на ионы ( К = 8·10 -10).
Синильная кислота — сильный яд, действующий смертельно даже в ничтожных дозах (меньше 0,05 г.).
Соли синильной кислоты называются цианидами. Из них наибольшее применение имеет цианид калия.
Цианид калия KCN — бесцветные кристаллы, хорошо растворимые в воде. Цианид калия так же ядовит, как и синильная кислота. На воздухе под действием CO 2он довольно быстро разлагается, выделяя синильную кислоту и превращаясь в карбонат:
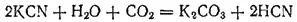
Как соль очень слабой кислоты, цианид калия в воде в сильной степени подвергается гидролизу:
Читать дальшеИнтервал:
Закладка:








