Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Большинство металлоз побочных подгрупп IV—VIII групп периодической системы образуют карбиды, связь в которых близка к металлической (см. § 190), вследствие чего эти карбиды в некоторых отношениях сходны с металлами, например обладают значительной электрической проводимостью. Они характеризуются также высокой твердостью и тугоплавкостью; карбиды этой группы применяются в ряде отраслей промышленности.
Большинство ценных свойств чугунов и сталей обусловлены присутствием в них карбида железа Fe 3C (см. § 238).
155. Диоксид углерода. Угольная кислота.
Диоксид углерода CO 2постоянно образуется в природе при окислении органических веществ (гниение растительных и животных остатков, дыхание, сжигание топлива). В больших количествах он выделяется из вулканических трещин и из вод минеральных источников.
В лабораториях диоксид углерода обычно получают, действуя на мрамор CaCO 3соляной кислотой в аппарате Киппа:
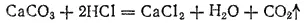
В промышленности большие количества диоксида углерода получают при обжиге известняка:
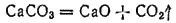
Диоксид углерода при обычных условиях — бесцветный газ, примерно в 1,5 раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Масса 1 л CO 2при нормальных условиях составляет 1,98 г. Растворимость диоксида углерода в воде невелика: 1 объем воды при 20°C растворяет 0,88 объема CO 2, а при 0°C - 1.7 объема. Применяется диоксид углерода при получении соды по аммиачно-хлоридному способу (см. стр. 426), для синтеза карбамида (стр. 427), для получения солей угольной кислоты, а также для газирования фруктовых и минеральных вод и других напитков.
Под давлением около 0.6 МПа диоксид углерода при комнатной температуре превращается в жидкость. Жидкий диоксид углерода хранят в стальных баллонах. При быстром выливании его из баллона поглощается вследствие испарения так много теплоты, что CO 2превращается в твердую белую снегообразную массу, которая, не плавясь, сублимируется при -78,5°C. Твердый диоксид углерода под названием «сухой лед» применяется для охлаждения скоропортящихся продуктов, для производства и сохранения мороженого, а также во многих других случаях, когда требуется получение низкой температуры.
Раствор CO 2в воде имеет кисловатый вкус и обладает слабокислой реакцией, обусловленной присутствием в растворе небольших количеств угольной кислоты H 2CO 3, образующейся в результате обратимой реакции:
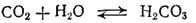
Таким образом, диоксид углерода является ангидридом угольной кислоты.
Равновесие последней реакции сильно сдвинуто влево лишь очень небольшое количество растворенного CO 2превращается в угольную кислоту.
Угольная кислота H 2CO 3может существовать только в водном растворе. При нагревании раствора диоксид углерода улетучивается, равновесие образования H 2CO 3смещается влево, и в конце концов остается чистая вода.
Угольная кислота очень слабая. В растворе она диссоциирует главным образом на ионы H +и HCO 3 -и лишь в ничтожном количестве образует ионы CO 3 2-:
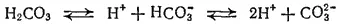
Константа диссоциации угольной кислоты по первой ступени, учитывающая равновесие ионов со всем количеством диоксида углерода в растворе (как в форме CO 2, так и в виде угольной кислоты), выражается соотношением:
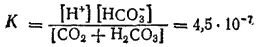
- 425 -
Константа диссоциации по второй ступени;
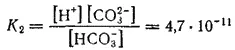
Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые; средние соли называются карбонатами, кислые — гидрокарбонатами.
Соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
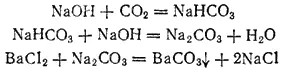
Со слабыми основаниями угольная кислота в большинстве случаев дает только основные соли, примером которых может служить карбонат гидроксомеди (CuOH) 2CO 3. Встречающийся в природе минерал такого состава называется малахитом.
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение CO 2легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением CO 2. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов, например:
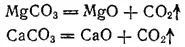
Гидрокарбонаты щелочных металлов при нагревании переходят в карбонаты:
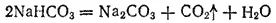
Большинство гидрокарбонатов, а также карбонаты калия, натрия, рубидия, цезия и аммония растворимы в воде; карбонаты других металлов в воде нерастворимы.
Растворы карбонатов щелочных металлов вследствие гидролиза имеют сильнощелочную реакцию
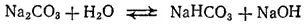
или
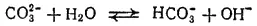
Из солей угольной кислоты в природе чрезвычайно распространен карбонат кальция CaCO 3. Он встречается в виде известняка, мела, мрамора.
Карбонат кальция нерастворим в воде. Поэтому известковая вода (раствор гидроксида кальция) при пропускании через нее диоксида углерода мутнеет:
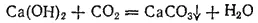
Однако, если пропускать CO 2через известковую воду долгое время, то мутная вначале жидкость постепенно светлеет и наконец становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли — гидрокарбоната кальция:
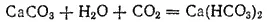
Интервал:
Закладка:








