Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Оксид сурьмы (III) растворяется также в щелочах с образованием солей сурьмянистой H 3SbO 3или метасурьмянистой HSbO 2кислоты. Например:
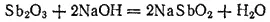
Сурьмянистая кислота, или гидроксид сурьмы (III), Sb(OH) 3получается в виде белого осадка при действии щелочей на соли сурьмы (III):
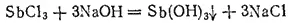
Осадок легко растворяется как в избытке щелочи, так и в кислотах.
Соли сурьмы (III), как соли слабого основания, в водном растворе подвергаются гидролизу с образованием основных солей:
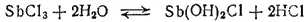
Образующаяся основная соль Sb(OH) 2Cl неустойчива и разлагается с отщеплением молекулы воды:
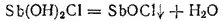
В соли SbOCl группа SbO играет роль одновалентного металла; эту группу называют антимонилом. Полученная основная соль называется или хлоридом антимонила, или хлороксидом сурьмы.
Оксид сурьмы(V), или сурьмяный ангидрид, Sb 2O 5обладает главным образом кислотными свойствами; ему соответствует сурьмяная кислота, существующая в водном растворе в нескольких формах. Соли сурьмяной кислоты называются антимонатами.
Сульфиды сурьмы Sb 2S 2и Sb 2S 5по свойствам аналогичны сульфидам мышьяка. Они представляют собой вещества оранжево-красного цвета, растворяющиеся в сульфидах щелочных металлов и аммония с образованием тиосолей. Сульфиды сурьмы используются при производстве спичек и в резиновой промышленности.
151. Висмут (Bismuthum).
Последний член подгруппы — висмут — характеризуется преобладанием металлических свойств над неметаллическими и может рассматриваться как металл.
Висмут — мало распространенный в природе элемент: содержание его в земной коре составляет 0,00002%(масс.). В природе он встречается как в свободном состоянии, так и в виде соединений - висмутовой охры Bi 2O 3и висмутового блеска Bi 2S 3.
В свободном состоянии висмут представляет собой блестящий розовато-белый хрупкий металл плотностью 9,8 г/см 3. Его применяют как в чистом виде, так и в сплавах. Чистый висмут используют главным образом в энергетических ядерных реакторах в качестве теплоносителя.
- 416 -
С некоторыми металлами висмут образует легкоплавкие сплавы; например, сплав висмута со свинцом, оловом и кадмием плавится при 70°C. Эти сплавы применяют, в частности, в автоматических огнетушителях, действие которых основано на расплавлении пробки, изготовленной из такого сплава. Кроме того, они используются как припои.
На воздухе висмут при комнатной температуре не окисляется, но при сильном нагревании сгорает, образуя оксид висмута Bi 2O 3. Соляная и разбавленная серная кислоты на висмут не действуют. Он растворяется в азотной кислоте невысокой концентрации и в горячей концентрированной серной:
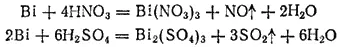
Висмутин, или гидрид висмута, BiH 3очень нестоек и разлагается уже при комнатной температуре.
Оксид висмута(III) Bi 2O 3образуется при прокаливании висмута на воздухе, а также при разложении нитрата висмута. Он имеет основной характер и растворяется в кислотах с образованием солей висмута(III).
Гидроксид висмута (III), или гидроокись висмута, Bi(OH) 3получается в виде белого осадка при действии щелочей на растворимые соли висмута:
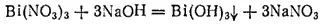
Гидроксид висмута(III) - очень слабое основание. Поэтому соли висмута (III) легко подвергаются гидролизу, переходя в основные соли, мало растворимые в воде.
Нитрат висмута, Bi(NO 3) 3·5H 2O, выкристаллизовывается из раствора, получающегося в результате взаимодействия висмута с азотной кислотой. Он растворяется в небольшом количестве воды, подкисленной азотной кислотой. При разбавлении раствора водой происходит гидролиз и выпадают основные соли, состав которых зависит от условий. Часто образуется соль состава BiONO 3. Радикал BiO — висмутил — играет роль одновалентного металла:
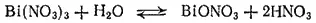
Хлорид висмута BiCl 3— гигроскопичные кристаллы, гидролизующиеся водой до хлорида висмутила BiOCl.
Сульфид висмута Bi 2S 3образуется в виде черно-бурого осадка при действии сероводорода на растворы солей висмута. Осадок не растворяется в сульфидах щелочных металлов и аммония: в отличие от мышьяка и сурьмы, висмут не образует тиосолей.
Соединения висмута (III) применяются в медицине и ветеринарии.
Действием очень сильных окислителей на соединения висмута (III) можно получить соединения висмута (V).
- 417 -
Важнейшие из них это висмуты — соли не выделенной в свободном состоянии висмутовой кислоты, например висмутат калия KBiO 3. Эти соединения представляют собой очень сильные окислители.
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
Главную подгруппу четвертой группы периодической системы образуют пять элементов — углерод, кремний, германий, олово и свинец.
При переходе от углерода к свинцу размеры атомов возрастают. Поэтому следует ожидать, что способность к присоединению электронов, а следовательно, и неметаллические свойства будут при этом ослабевать, легкость же отдачи электронов — возрастать. Действительно, уже у германия проявляются металлические свойства, а у олова и свинца они преобладают над неметаллическими. Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют и к металлам, и к неметаллам, олово и свинец—металлы.
Для элементов рассматриваемой группы характерны степени окисленности +2 и +4. Соединения углерода и кремния, в которых степень окисленности этих элементов равна +2, немногочисленны и сравнительно малостойки.
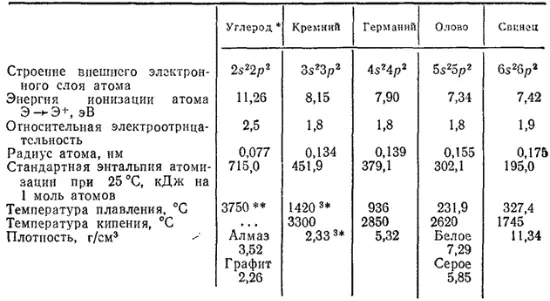
Таблица 28. Некоторые свойства углерода и его аналогов
- 418 -
Некоторые свойства элементов главной подгруппы четвертой группы и образуемых ими простых веществ охарактеризованы в табл. 28.
152. Углерод в природе.
Углерод находится в природе как в свободном состоянии, так и в виде многочисленных соединений. Свободный углерод встречается в виде алмаза и графита. Алмазы образуют отдельные кристаллы или небольшого размера сростки, масса которых обычно колеблется от тысячных до десятых долей грамма. Самый большой из найденных алмазов весил 621,2 г. Кристаллы нередко имеют окраску, обусловленную примесями. Крупнейшие месторождения алмазов имеются в Африке (Заир, ЮАР), в Бразилии, в Индии.
Читать дальшеИнтервал:
Закладка:








