Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кислотные свойства мышьяковой кислоты выражены значительно сильнее, чем у мышьяковистой. В этом проявляется рассмотренная на стр. 357 и 358 общая закономерность, согласно которой с повышением степени окисленности элемента кислотные свойства его гидроксидов усиливаются, а основные — ослабевают.
Будучи трехосновной, мышьяковая кислота образует средние (арсенаты) и кислые (гидро- и дигидроарсенаты) соли, например Na 3AsO 4, Na 2HAsO 4, NaH 2AsO 4.
В кислой среде мышьяковая кислота и арсенаты проявляют свойства окислителей.
В § 99 отмечалось, что электродные потенциалы процессов, протекающих с участием воды, ионов водорода или гидроксид-иопов, имеют тем большую величину, чем кислее раствор. Иначе говоря, если в электрохимическом процессе принимает участие вода и продукты ее диссоциации, то окислитель сильнее проявляет окислительные свойства в кислой среде, а восстановитель сильнее проявляет восстановительные свойства в щелочной среде. Эта общая закономерность хорошо видна на примере соединений мышьяка. Мышьяковая кислота и ее соли в кислой среде взаимодействуют с восстановителями, переходя в мышьяковистую кислоту или в арсениты. Например:
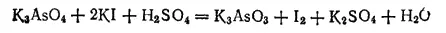
- 413 -
Здесь процесс восстановления описывается уравнением:
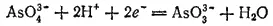
а процесс окисления — уравнением:
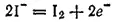
Видно, что восстановление протекает с участием воды и ионов H+, а окисление — без их участия. Следовательно, pH среды влияет только на потенциал процесса восстановления: чем меньше pH, тем выше этот потенциал и тем более сильным окислителем является AsO 4 3-.
В то же время в щелочной среде мышьяковистая кислота и ее соли легко окисляются, переходя в арсенаты, например:

Здесь процесс восстановления описывается уравнением:
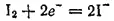
а процесс окисления — уравнением:
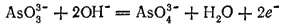
В этом случае вода и ионы ОН- принимают участие только в окислении. Следовательно, здесь pH среды влияет лишь на потенциал процесса окисления: чем больше pH, тем ниже этот потенциал и тем более сильным восстановителем служит AsO 3 3-.
Таким образом, мы видим, что направление протекания окислительно-восстановительных реакций, идущих с участием воды и продуктов ее диссоциации, может изменяться при переходе от кислой среды к щелочной.
Сульфиды мышьяка. Если пропускать сероводород в подкисленный соляной кислотой раствор мышьяковистой кислоты, то образуется желтый осадок сульфида As 2S 3, нерастворимый в соляной кислоте. Происходящие реакции можно выразить уравнениями
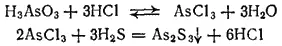
Аналогично можно получить желтый осадок сульфида мышьяка(V) As 2S 5, действуя сероводородом на раствор мышьяковой кислоты в присутствии соляной кислоты:
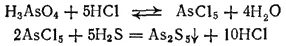
При взаимодействии сульфидов мышьяка с сульфидами щелочных металлов Na 2S, K 2S или с сульфидом аммония (NH 4) 2S образуются растворимые в воде соли тиомышьяковистой (H 3AsS 3) и тиомышьяковой (H 3AsS 4) кислот. Кислоты H 3AsS 3и H 3AsS 4можно рассматривать как соответствующие кислородсодержащие кислоты мышьяка, в которых весь кислород замещен серой:
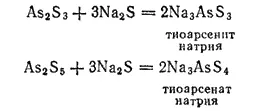
Применение свободного мышьяка ограничено.
- 414 -
Но соединения мышьяка применяют в медицине, а также в сельском хозяйстве, где они используются в качестве инсектицидов, т. е. средств для уничтожения вредных насекомых.
Оксид мышьяка (III) применяется как яд для уничтожения грызунов.
150. Сурьма (Stibium).
Сурьма обычно встречается в природе в соединении с серой — в виде сурьмяного блеска, или антимонита, Sb 2S 3. Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико [0,00005% (масс.)], сурьма была известна еще в глубокой древности. Это объясняется распространенностью в природе сурьмяного блеска и легкостью получения из него сурьмы. При прокаливании на воздухе сурьмяный блеск превращается в оксид сурьмы Sb 2S 3, из которого сурьма получается путем восстановления углем.
В свободном состоянии сурьма образует серебристо-белые кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см 3. Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит теплоту и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения.
Сурьму вводят в некоторые сплавы для придания им твердости. Сплав, состоящий из сурьмы, свинца и небольшого количества олова, называется типографским металлом или гартом и служит для изготовления типографского шрифта. Из сплава сурьмы со свинцом (от 5 до 15% Sb) изготовляют пластины свинцовых аккумуляторов, листы и трубы для химической промышленности. Кроме того, сурьму применяют как добавку к германию для придания ему определенных полупроводниковых свойств.
В царской России, несмотря на наличие сырьевой базы, сурьму не получали. Выплавка сурьмы из отечественных руд началась лишь после Октябрьской революции.
В своих соединениях сурьма обнаруживает большое сходство с мышьяком, но отличается от него более сильно выраженными металлическими свойствами.
Стибин, или гидрид сурьмы, SbH 3— ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
Сурьма образует соединения с металлами — антимониды, - которые можно рассматривать как продукты замещения водорода в стибине атомами металла. В этих соединениях сурьма, как и в SbH 3, имеет степень окисленности —3. Некоторые из антимонидов, в частности AlSb, GaSb и InSb, обладают полупроводниковыми свойствами и используются в электронной промышленности.
Оксид сурьмы(III), или сурьмянистый ангидрид, Sb 2O 3типичный амфотерный оксид с некоторым преобладанием основных свойств.
- 415 -
В сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III):
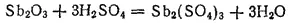
Интервал:
Закладка:








