Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 407 -
Хлориды фосфора применяются при синтезах различных органических веществ.
147. Оксиды и кислоты фосфора.
К важнейшим оксидам фосфора принадлежат P 2O 3и P 2O 5.
Оксид фосфора(III), или фосфористый ангидрид, P 2O 3получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23б8°C. Молекулярная масса его при низких температурах соответствует формуле P 4O 6. При действии холодной воды оксид фосфора(III) медленно взаимодействует с ней, образуя фосфористую кислоту H 3PO 3. Как оксид фосфора(III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора(V), или фосфорный ангидрид, P 2O 5образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы. Плотность его пара соответствует формуле P 4O 10.
Оксид фосфора(V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид фосфора(V), притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
Фосфорные кислоты. Оксиду фосфора(V) отвечает несколько кислот. Важнейшая из них — это ортофосфорная кислота H 3PO 4, называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии sp 3-гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры PO 4объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка 10 5- атомов фосфора.
Ортофосфорная кислота H 3PO 4образует бесцветные прозрачные кристаллы, плавящиеся при 42,35°C. В воде она растворяется очень хорошо.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Константы ее диссоциации равны: K 1=8·10 -3, K 2=6·10 -8, K 3=10 -12. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами:

- 408 -
Дигидрофосфаты растворимы в воде; из гидрофосфатов и средних фосфатов хорошо растворимы лишь соли щелочных металлов и аммония.
В водных растворах фосфаты гидролизуются. При этом растворы средних солей щелочных металлов имеют сильно щелочную реакцию. Например, pH 1% раствора Na 3PO 4равен 12,1. В случае кислых солей гидролиз сопровождается диссоциацией кислотного остатка (см. § 92). Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидрофосфатов этих металлов — слабокислую. Например, pH 1% раствора Na 2HPO 4равен 8,9 а NaH 2PO 4- 6,4.
В лаборатории фосфорную кислоту можно получать окислением фосфора 30%-ной HNO 3. Реакция протекает согласно уравнению;
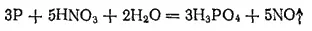
В промышленности фосфорную кислоту получают двумя методами; экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:
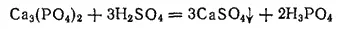
Образующуюся фосфорную кислоту отфильтровывают от сульфата кальция и концентрируют выпариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием и растворением образующегося фосфорного ангидрида в воде. Получаемая по этому методу термическая фосфорная кислота отличается более высокой чистотой и повышенной концентрацией.
Помимо производства удобрений (см. § 148), фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для создания защитных покрытий на металлах. Фосфаты кальция и аммония применяются при производстве эмалей, в фармацевтической промышленности.
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров PO 4. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей. В зависимости от способа соединения групп PO 4в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифосфорные кислоты и их соли — полифосфаты — построены из цепочек -PO 3-O-PO 3-. В метафосфорных кислотах и их солях - метафосфатах — тетраэдры PO 4образуют кольца.
Из полифосфорных кислот в кристаллическом состоянии выделена только простейшая двуфосфорная (или пирофосфорная) кислота H 4P 2O 7, образующая бесцветные кристаллы, плавящиеся при 61°C. Ион P 2O 7 4-построен из двух тетраэдров PO 4с общим атомом кислорода.
- 409 -
Структурная формула двуфосфорной кислоты:
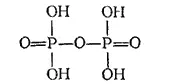
Двуфосфорная кислота хорошо растворяется в воде и является несколько более сильной кислотой, чем H 3PO 4(K 1= 1,4·10 -1, K 2= 10 -2, K 3= 2·10 -7, K 4= 4·10 -10). Ее соли называются дифосфатами, или пирофосфатами.
Метафосфорные кислоты имеют общую формулу H nP nO 3n, где n может принимать значения от 3 до 8; однако часто их состав выражают простейшей формулой HPO 3. Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфорные кислоты. Метафосфорные кислоты, ядовиты. Известны соли метафосфорных кислот — мета фосфаты. Некоторые из них выделены в виде кристаллов, например Na 3P 3O 9, Na 4P 4O 12, Ca 3(P 3O 9) 2. Метафосфаты применяются для умягчения воды и снижения ее коррозионной активности, для удаления накипи с паровых котлов, а также входят в состав некоторых моющих средств.
148. Минеральные удобрения.
Как уже указывалось выше, для повышения урожайности сельскохозяйственных культур огромное значение имеет внесение в почву элементов, необходимых для роста и развития растений. Эти элементы вносятся в почву в виде органических (навоз, торф и др.) и минеральных (продукты химической переработки минерального сырья) удобрений. Производство последних является одной из важнейших отраслей химической промышленности.
К важнейшим минеральным удобрениям принадлежат фосфорные удобрения. Природные соединения фосфора — фосфориты и апатиты — содержат фосфор в виде нерастворимого среднего фосфата Ca 3(PO 4) 2, который плохо усваивается растениями. Для получения легко усваиваемых удобрений фосфориты подвергают химической переработке, заключающейся в превращении средней соли в кислую. Таким путем приготовляют наиболее важные фосфорные удобрения — суперфосфат, двойной суперфосфат и преципитат.
Читать дальшеИнтервал:
Закладка:








