Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия NaNO 3, или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия KNO 3, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
- 402 -
Нитрат кальция Ca(NO 3) 2, или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
Нитрат аммония NH 4NO 3— см. стр. 390.
143. Промышленное получение азотной кислоты.
Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При описании свойств аммиака (см. § 137) было указано, что он горит в кислороде, причем продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750°C и определенном составе смеси происходит почти полное превращение NH 3в NO:
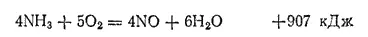
Образовавшийся NO легко переходит в NO 2, который с водой в присутствии кислорода воздуха дает азотную кислоту (см. § 140).
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют.
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная — 98 и 97%. Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
144. Круговорот азота в природе.
При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в почве нитрифицирующих бактерий окисляется затем в азотную кислоту. Последняя, вступая в реакцию с находящимися в почве карбонатами, например с карбонатом кальция CaCO 3, образует нитраты;
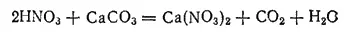
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растений, возвращается обратно в почву; часть его постепенно выделяется в свободном виде.
Непрерывная убыль минеральных азотных соединений давно должна была бы привести к полному прекращению жизни на Земле, если бы в природе не существовали процессы, возмещающие потери азота. К таким процессам относятся прежде всего происходящие в атмосфере электрические разряды, при которых всегда образуется некоторое количество оксидов азота; последние с водой дают азотную кислоту, превращающуюся в почве в нитраты. Другим источником пополнения азотных соединений почвы является жизнедеятельность так называемых азотобактерий, способных усваивать атмосферный азот. Некоторые из этих бактерий поселяются на корнях растений из семейства бобовых, вызывая образование характерных вздутий - "клубеньков", почему они и получили название клубеньковых бактерий. Усваивая атмосферный азот, клубеньковые бактерии перерабатывают его в азотные соединения, а растения, в свою очередь, превращают последние в белки и другие сложные вещества.
Таким образом, в природе совершается непрерывный круговорот азота. Однако ежегодно с урожаем с полей убираются наиболее богатые белками части растений, например зерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в ней важнейших элементов питания растений.
Изучение вопросов питания растений и повышения урожайности последних путем применения удобрений является предметом специальной отрасли химии, получившей название агрохимии. Большой вклад в развитие этой науки внесен французским ученым Ж. Б. Буссенго (1802—1887), немецким химиком Ю. Либихом (1803—1873) и русским ученым Д. Н. Пряшниковым.
ФОСФОР (PHOSPHORUS)
145. Фосфор в природе. Получение и свойства фосфора.
Фосфор принадлежит к числу довольно распространенных элементов; содержание его в земной коре составляет около 0,1%(масс.). Вследствие легкой окисляемости фосфор в свободном состоянии в природе не встречается.
Из природных соединений фосфора самым важным является ортофосфат кальция Ca 3(PO 4) 2, который в виде минерала фосфорита иногда образует большие залежи. В СССР богатейшие месторождения фосфоритов находятся в Южном Казахстане в горах Каратау. Часто встречается также минерал апатит, содержащий, кроме Ca 3(PO 4) 2, еще CaF 2или CaCl 2. Огромные залежи апатита были открыты в двадцатых годах нашего столетия на Кольском полуострове.
Это месторождение по своим запасам самое большое в мире.
Фосфор, как и азот, необходим для всех живых существ, так как он входит в состав некоторых белков как растительного, так и животного происхождения. В растениях фосфор содержится главным образом в белках семян, в животных организмах — в белках молока, крови, мозговой и нервной тканей. Кроме того, большое количество фосфора содержится в костях позвоночных животных в основном в виде соединений 3Ca 3(PO 4) 2·Ca(OH) 2и 3Ca 3(PO 4) 2·CaCO 3·H 2O. В виде кислотного остатка фосфорной кислоты фосфор входит в состав нуклеиновых кислот — сложных органических полимерных соединений, содержащихся во всех живых организмах. Эти кислоты принимают непосредственное участие в процессах передачи наследственных свойств живой клетки.
Сырьем для получения фосфора и его соединений служат фосфориты и апатиты. Природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха.
Читать дальшеИнтервал:
Закладка:








