Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Синтез аммиака можно проводить при различных давлениях от 15 до 100 МПа. Наибольшее распространение получили системы, работающие при среднем давлении (30 МПа); в экономическом отношении они наиболее целесообразны.
В настоящее время синтез аммиака является основным способом связывания атмосферного азота.
139. Гидразин. Гидроксиламин. Азидоводород.
Кроме аммиака, азот образует еще несколько соединений с водородом, не имеющих, однако, такого значения, как аммиак. Важнейшие из них следующие.
Гидразин N 2H 4— бесцветная жидкость, кипящая при 113,5°C, получается при действии гипохлорита натрия NaClO на концентрированный раствор аммиака.
Структурная формула гидразина:
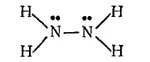
В молекуле гидразина атомы азота имеют неподеленные пары электронов. Это обусловливает способность гидразина к реакциям присоединения. Гидразин хорошо растворяется в воде, а при взаимодействии с кислотами присоединяет по донорно-акцепторному способу один или два иона водорода, образуя два ряда солей — например хлориды гидразоиня N 2H 4·HCl и N 2H 4·2HCl. Таким образом, гидразин обладает основными свойствами.
Гидразин — хороший восстановитель. При его горении в атмосфере воздуха или кислорода выделяется очень большое количество теплоты, вследствие чего гидразин нашел применение в качестве составной части топлива ракетных двигателей. Гидрозин и все его производные сильно ядовиты.
- 394 -
Гидроксиламин NH 2OH — бесцветные кристаллы (темп. плавл. около 33°C). Его структурная формула:
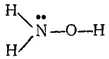
В молекуле гидрокснламнна атом азота имеет неподелспную пару электронов. Поэтому, подобно аммиаку и гидразину, он способен к реакциям присоединения с образованием связен по доиорно-акцепторному способу. Гидроксиламин хорошо растворяется в воде, а с кислотами дает соли, например хлорид гидроксиламмония (NH 3OH)Cl. Степень окислениости азота в гидроксила мине равна —1. Поэтому он проявляет как восстановительные, так и окислительные свойства. Однако более характерна восстановительная способность гидроксиламина. В частности, он применяется как восстановитель (главным образом в виде солей) в лабораторной практике. Кроме того, его используют в производстве некоторых органических веществ.
Азидоводород, или азотистоводородная кислота, HN 3может быть получен действием азотистой кислоты HNO 2на водный раствор гидразина; он представляет собой бесцветную жидкость (темп. кип. 36°C) с резким запахом.
Азидоводород принадлежит к числу слабых кислот (K=3·10 -5). В водном растворе он диссоциирует на ионы H+ и N 3 -. Анион азидоводорода N 3имеет линейное строение. Его электронную структуру можно выразить схемой:
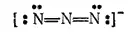
Как сам азидоводород, так и его соли — азиды — очень взрывчаты. Азид свинца Pb(N 3) 2применяется для снаряжения капсюлей-детонаторов.
140. Оксиды азота.
Азот образует с кислородом ряд оксидов; все они могут быть получены из азотной кислоты или ее солей.
Оксид азота (I), или закись азота, N 2O получается при нагревании нитрата аммония:
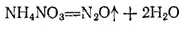
Оксид азота (I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при 20°C растворяет 0,63 объема N 2O.
Оксид азота (I) - термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна (ΔG° обр=104 кДж/моль). Однако вследствие большой прочности связей в молекуле N 2O энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада N 2O. Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни со щелочью оксид азота (I) не реагирует.
Электронная структура молекулы N 2O рассмотрена в § 41.
Вдыхание небольших количеств оксида азота (I) приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза.
- 395 -
Большие количества оксида азота (I) действуют на нервную систему возбуждающе; поэтому раньше его называли «веселящим газом».
Оксид азота(II), или окись азота, NO представляет собой бесцветный трудно сжижаемый газ. Жидкий оксид азота (II) кипит при NO и затвердевает при -151,7°C. В воде он мало растворим: 1 объем воды растворяет при 0°C всего 0,07 объема NO.
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно N 2O оксид азота (II) термодинамически неустойчив - стандартная энергия Гиббса его образования положительна (ΔG° обр=86,6 кДж/моль). Но, опять-таки подобно N 2O, при комнатной температуре NO не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше 1000°C его распад на азот и кислород начинает протекать с заметной скоростью. При очень высоких температурах, по причинам, рассмотренным в § 65, распад NO проходит не до конца — в системе NO-N 2-O 2устанавливается равновесие. Благодаря этому оксид азота (II) можно получить из простых веществ при температурах электрической дуги (3000-4000°C).
В лаборатории оксид азота (II) обычно получают взаимодействием 30—35%-ной азотной кислоты с медью:
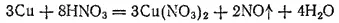
В промышленности он является промежуточным продуктом при производстве азотной кислоты (см. § 143).
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
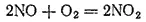
В то же время смесь равных объемов NO и H 2при нагревании взрывает:
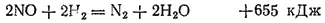
Электронная структура молекулы NO лучше всего описывается методом МО. На рис. 116 представлена схема заполнения МО в молекуле NO. с аналогичными схемами для молекул N 2и СО — рис. 51 и 53 на стр. 142 и 143). Молекула NO имеет на один электрон больше, чем молекулы N 2и СО: этот электрон находится на разрыхляющей орбитали π разр2p. Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2 = 2,5). Действительно, энергия диссоциации молекулы NO на атомы (632 кДж/моль) имеет промежуточное значение по сравнению с соответствующими величинами для молекулы O 2(498 кДж/моль), в которой кратность связи равна двум, и молекулы N 2(945 кДж/моль), где связь тройная.
Читать дальшеИнтервал:
Закладка:








