Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
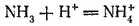
В этой реакции аммиак служит акцептором протона и, следовательно, с точки зрения протонной теории кислот и оснований (стр. 237) проявляет свойства основания. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. Например, с соляной кислотой получается хлорид аммония NH 4Cl:
NH 3+ HCl = NH 4Cl
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
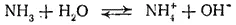
В результате концентрация ионов OH- в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако по установившейся традиции водный раствор аммиака обычно обозначают формулой NH 4OH и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат диссоциации молекул NH 4OH.
Аммиак — слабое основание. При 18°C константа равновесия его ионизации (см. предыдущее уравнение) равна 1.8·10 -5. В 1 л одномолярного водного раствора аммиака содержится всего лишь 0,0042 эквивалента ионов OH- и NH 4 +; такой раствор при 18°C имеет pH 11.77.
Большинство солей аммония бесцветны и хорошо растворимы в воде. По некоторым своим свойствам они подобны солям щелочных металлов, особенно калия (ионы K +и NH 4 +имеют близкие размеры).
Поскольку водный раствор аммиака представляет собой слабое основание, то соли аммония в растворах гидролизуются. Растворы солей, образованных аммиаком и сильными кислотами, имеют слабокислую реакцию.
Гидролиз иона аммония обычно записывают в такой форме:
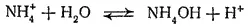
Однако правильнее рассматривать его как обратимый переход протона от иона аммония к молекуле воды:
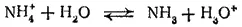
- 389 -
При добавлении щелочи к водному раствору какой-либо соли аммония ионы H 3O +связываются ионами ОН- в молекулы воды и равновесие гидролиза смещается вправо. Происходящий при этом процесс можно выразить уравнением:
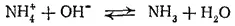
При нагревании раствора аммиак улетучивается, в чем нетрудно убедиться по запаху. Таким образом, присутствие любой аммонийной соли в растворе можно обнаружить, нагревая раствор со щелочью (реакция на ион аммония).
Соли аммония термически неустойчивы. При нагревании они разлагаются. Это разложение может происходить обратимо или необратимо. Соли аммония, анион которых не является окислителем или лишь в слабой степени проявляет окислительные свойства, распадаются обратимо. Например, при нагревании хлорид аммония как бы возгоняется — разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
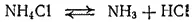
При обратимом распаде солей аммония, образованных нелетучими кислотами, улетучивается только аммиак. Однако продукты разложения — аммиак и кислота, — будучи смешаны, вновь соединяются друг с другом. Примерами могут служить реакции распада сульфата аммония (NH 4) 2SO 4или фосфата аммония (NH 4) 3PO 4.
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает окислительно-восстановительная реакция, в ходе которой ион аммония окисляется, а анион восстанавливается. Примерами могут служить распад NH 4NO 2(§ 136) или разложение нитрата аммония:
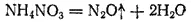
Аммиак и соли аммония находят широкое применение. Как уже говорилось, аммиак даже при невысоком давлении (0,7-0,8 МПа) легко превращается в жидкость. Поскольку при испарении жидкого аммиака поглощается большое количество теплоты (1,37 кДж/г), то жидкий аммиак используется в различных холодильных устройствах.
Водные растворы аммиака применяются в химических лабораториях и производствах как слабое легколетучее основание; их используют также в медицине и в быту. Но большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, а также других азотсодержащих веществ. К важнейшим из них относятся азотные удобрения, прежде всего сульфат и нитрат аммония и карбамид (стр. 427).
Сульфат аммония (NH 4) 2SO 4служит хорошим удобрением и производится в больших количествах.
- 390 -
Нитрат аммония NH 4NO 3тоже применяется в качестве удобрения; процентное содержание усвояемого азота в этой соли выше, чем в других нитратах или солях аммония. Кроме того, нитрат аммония образует взрывчатые смеси с горючими веществами (аммоналы), применяемые для взрывных работ.
Хлорид аммония, или нашатырь, NH 4Cl применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
4CuO + 2NH 4Cl = 3Cu + CuCl 2+ N 2+ 4H 2O
Fe 3O 4+ 8NH 4Cl = FeCl 2+ 2FeCl 3+ 8NH 3+ 4H 2O
Первая из этих реакций является окислительно-восстановительной: медь, будучи менее активным металлом, чем железо, восстанавливается аммиаком, который образуется при нагревании NH 4Cl.
Жидкий аммиак и насыщенные им растворы аммонийных солей применяют в качестве удобрений. Одним из главных преимуществ таких удобрений является повышенное содержание в них азота.
138. Фиксация атмосферного азота. Получение аммиака.
До конца прошлого столетия аммиак получался в промышленном масштабе исключительно как побочный продукт при коксовании каменного угля. Каменный уголь содержит от 1 до 2% азота. При сухой перегонке угля почти весь этот азот выделяется в виде аммиака и солей аммония. Отделение аммиака и солей аммония от других газообразных продуктов сухой перегонки достигается пропусканием коксового газа через воду. Из этой аммиачной или, как ее называют, газовой воды аммиак выделяется при нагревании с известью.
Читать дальшеИнтервал:
Закладка:








