Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Теллур тоже известен в виде аморфной модификации и в виде кристаллов светло-серого цвета, обладающих металлическим блеском.
Селен — типичный полупроводник (см. § 190). Важным свойством его как полупроводника является резкое увеличение электрической проводимости при освещении. На границе селена с металлическим проводником образуется запорный слой — участок цепи, способный пропускать электрический ток только в одном направлении. В связи с этими свойствами селен применяется в полупроводниковой технике для изготовления выпрямителей и фотоэлементов с запорным слоем. Теллур — тоже полупроводник, но его применение более ограничено. Селениды и теллуриды некоторых металлов также обладают полупроводниковыми свойствами и применяются в электронике. В небольших количествах теллур служит легирующей добавкой к свинцу, улучшая его механические свойства.
Селеноводород H 2Se и теллуроводород H 2Te представляют собой бесцветные газы с отвратительным запахом. Водные растворы их являются кислотами, константы диссоциации которых несколько больше, чем константа диссоциации сероводорода.
В химическом отношении селеноводород и теллуроводород чрезвычайно похожи на сероводород. Как и сероводород, они в сильной степени обладают восстановительными свойствами. При нагревании оба они разлагаются. При этом H 2Te менее стоек, чем H 2Se: подобно тому, как это происходит в ряду галогеноводородов, прочность молекул уменьшается при переходе H 2O →H 2S→H 2Se→H 2Te. Соли селеноводорода и теллуроводорода — селениды и теллуриды — сходны с сульфидами в отношении растворимости в воде и кислотах. Действуя на селениды и теллуриды сильными кислотами, можно получить селеноводород и теллуроводород.
При сжигании селена и теллура на воздухе или в кислороде получаются диоксиды SeO 2и TeO 2, находящиеся при обычных условиях в твердом состоянии и являющиеся ангидридами селенистой H 2SeO 3и теллуристой H 2TeO 3кислот.
- 383 -
В отличие от диоксида серы, SeO 2и TeO 2проявляют преимущественно окислительные свойства, легко восстанавливаясь до свободных селена и теллура, например:
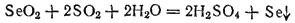
Действием сильных окислителей диоксиды селена и теллура могут быть переведены соответственно в селеновую H 2SeO 4и теллуровую H 2TeO 4кислоты.
Селеновая кислота H 2SeO 4принадлежит к сильным кислотам. Подобно серной кислоте, она малолетуча, энергично соединяется с водой, обугливает органические вещества и обладает сильными окислительными свойствами. Соли ее — селенаты — очень похожи на сульфаты. Бариевая и свинцовая соли этой кислоты, как и соответствующие соли серной кислоты, нерастворимы.
Теллуровая кислота H 2TeO 4, в отличие от селеновой и серной, очень слабая кислота. Из раствора она выделяется в виде кристаллов ортотеллуровой кислоты состава H 6TeO 6. Это шестиосновная кислота; она образует ряд солей, например ортотеллурат серебра Ag 6TeO 6. При нагревании ортотеллуровая кислота отщепляет две молекулы воды и переходит в двухосновную кислоту H 2TeO 4.
Все соединения селена и теллура ядовиты.
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут.
Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна +5 , а отрицательная —3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода и, таким образом, не обладают кислотными свойствами.
Физические и химические свойства элементов подгруппы азота изменяются с увеличением порядкового номера в той же последовательности, которая наблюдалась в ранее рассмотренных группах.
- 384 -
Но так как неметаллические свойства выражены у азота слабее, чем у кислорода и тем более фтора, то ослабление этих свойств при переходе к следующим элементам влечет за собой появление и нарастание металлических свойств. Последние заметны уже у мышьяка, сурьма приблизительно в равной степени обладает теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими.
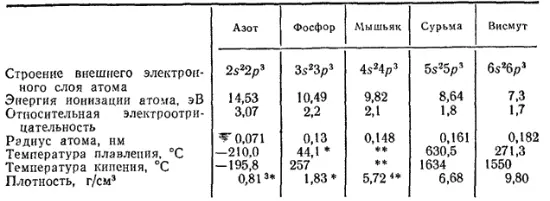
Важнейшие свойства элементов рассматриваемой подгруппы приведены в табл. 27.
Таблица 27. Некоторые свойства азота и его аналогов
АЗОТ (NITROGENIUM)*
136. Азот в природе. Получение и свойства азота.
Большая часть азота находится в природе в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO 3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений — белков — азот входит в состав всех живых организмов. Превращения, которым подвергаются белки в клетках растений и животных, составляют основу всех жизненных процессов. Без белка нет жизни, а так как азот является обязательной составной частью белка, то понятно, какую важную роль играет этот элемент в живой природе.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04 (масс.).
* Название "азот" происходит от греческого слова "азоос", что значит безжизненный. Латинское название азота - nitrogenium - буквально означает "рождающий селитру"
- 385 -
Получение азота из воздуха сводится в основном к отделению его от кислорода. В промышленности это осуществляется путем испарения жидкого воздуха в специальных установках.
В лабораториях обычно пользуются азотом, поставляемым в баллонах под повышенным давлением или в сосудах Дьюара. Можно получать азот разложением некоторых его соединений, например нитрита аммония NH 4NO 2, который разлагается с выделением азота при сравнительно небольшом нагревании:
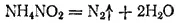
В молекуле азота N 2атомы связаны тройной связью. Энергия диссоциации этой молекулы очень велика (945 кДж/моль), поэтому термическая диссоциация азота делается заметной лишь при очень сильном нагревании (при 3000°C диссоциирует около 0.1%).
Читать дальшеИнтервал:
Закладка:








