Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Триоксид серы — ангидрид серкой кислоты; последняя образуется при взаимодействии SO 3с водой:
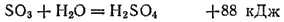
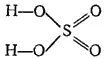
Структура молекул серной кислоты соответствует формуле:
Безводная H 2SO 4бесцветная маслянистая жидкость, кристаллизующаяся при 10.3°C.
При нагревании безводная серная кислота (так называемый «моногидрат») отщепляет SO 3, который улетучивается. Отщепление идет до тех пор, пока не получится азеотропный раствор. Он содержит 98,3% (масс.) H 2SO 4и 1,7% (масс.) воды. Этот раствор кипит и перегоняется без изменения состава при 338,8°C. Азеотропный раствор в конечном счете получается и при перегонке разбавленной серной кислоты. В этом случае отгоняется преимущественно вода до тех пор, пока концентрация кислоты не достигает 98,3%.
При растворении серной кислоты в воде образуются гидраты и выделяется очень большое количество теплоты. Поэтому смешивать концентрированную серную кислоту с водой следует с осторожностью. Во избежание разбрызгивания разогретого поверхностного слоя раствора, надо вливать серную кислоту (как более тяжелую) в воду небольшими порциями или тонкой струйкой; ни в коем случае не следует вливать воду в кислоту.
Серная кислота жадно поглощает пары воды и поэтому часто применяется для осушения газов. Способностью поглощать воду объясняется - и обугливание многих органических веществ, особенно относящихся к классу углеводов (клетчатка, сахар и др.), при действии на них концентрированной серной кислоты. В состав углеводов водород и кислород - входят в таком же отношении, в каком они находятся в воде. Серная кислота отнимает от углеводов водород и кислород, которые образует воду, а углерод выделяется в виде угля.
- 375 -
Концентрированная серная кислота, особенно горячая, — энергичный окислитель. Она окисляет HI и HBr (но не HCl) до свободных галогенов, уголь — до CO 2, серу — до SO 2. Указанные реакции выражаются уравнениями:
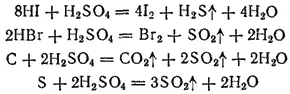
Взаимодействие серной кислоты с металлами протекает различно в зависимости от ее концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Поэтому она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например:
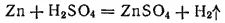
Однако свинец не растворяется в разбавленной кислоте, поскольку образующаяся соль PbSO 4нерастворима.
Концентрированная серная кислота является окислителем за счет серы(VI). Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты ее восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура). При взаимодействии с малоактивными металлами, например с медью, кислота восстанавливается до SO 2:
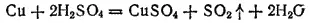
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO 2, так и свободная сера и сероводород. Например, при взаимодействии с цинком могут протекать реакции:
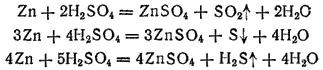
О действии серной кислоты на железо см. § 242.
Серная кислота — сильная двухосновная кислота. По первой ступени в растворах невысокой концентраций она диссоциирует практически нацело:
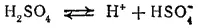
Диссоциация по второй ступени
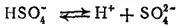
протекает в меньшей степени. Константа диссоциации серной кислоты по второй ступени, выраженная через активности ионов, K 2= 10 -2.
- 376 -
Как кислота двухосновная, серная кислота образует два ряда солей: средние и кислые. Средние соли серной кислоты называются сульфатами, а кислые — гидросульфатами.
Большинство солей серной кислоты довольно хорошо растворяется в воде. К практически нерастворимым относятся сульфаты бария BaSO 4, стронция SrSO 4и свинца PbSO 4. Мало растворим сульфат кальция CaSO 4. Произведение растворимости BaSO 4равно 1,1·10 -10, SrSO 43,2·10 -7, PbSO 41,6·10 -8, CaSO 41,3·10 -4.
Сульфат бария нерастворим не только в воде, но и в разбавленных кислотах. Поэтому образование белого нерастворимого в кислотах осадка при действии на какой-нибудь раствор солью бария служит указанием на присутствие в этом растворе ионов SO 4 2-:
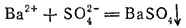
Таким образом, растворимые соли бария служат реактивом на сульфатион.
К важнейшим солям серной кислоты относятся следующие.
Сульфат натрия NaSO 4. Кристаллизуется из водных растворов с десятью молекулами воды (NaSO 4·10H 2O) и в таком виде называется глауберовой солью по имени немецкого врача и химика И. Р. Глаубера, который первым получил ее действием серной кислоты на хлорид натрия. Безводная соль применяется при изготовлении стекла.
Сульфат калия K 2SO 4. Бесцветные кристаллы, хорошо растворимы в воде. Образует ряд двойных солей, в частности квасцы (см. ниже).
Сульфат магния MgSO 4. Содержится в морской воде. Из растворов кристаллизуется в виде гидрата MgSO 4·7H 2O.
Сульфат кальция CaSO 4. Встречается в природе в больших количествах в виде минерала гипса CaSO 4·2H 2O. При нагревании до 150-170°C гипс теряет 3/4 содержащейся в нем кристаллизационной воды и переходит в так называемый жженый гипс, или алебастр (2CaSO 4·H 2O). Будучи замешан с водой в жидкое тесто, жженый гипс довольно быстро затвердевает, снова превращаясь в CaSO 4·2H 2O. Благодаря этому свойству гипс применяется для изготовления отливочных форм и слепков с различных предметов, а также в качестве вяжущего материала для штукатурки стен и потолков. В хирургии при переломах используют гипсовые повязки.
Безводный сульфат кальция называется ангидритом.
Купоросы. Так называются сульфаты меди, железа, цинка и некоторых других металлов, содержащие кристаллизационную воду.
Медный купорос CuSO 4·5H 2O образует синие кристаллы. Применяется для электролитического покрытия металлов медью, для приготовления некоторых минеральных красок, а также в качестве исходного вещества при получении других соединений меди.
Читать дальшеИнтервал:
Закладка:








