Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 366 -
Образовавшейся структуре соответствует валентная схема А, на которой точками обозначены неподеленные пары электронов, а σ- и π-связи помечены буквами.
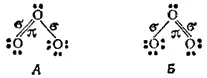
Согласно схеме А, связи центрального атома кислорода с двумя крайними атомами неравноценны — одна из них двойная, а другая простая. Однако одинаковая длина этих связей (рис. 110) указывает на их равноценность. Поэтому, наряду со схемой А, строение Молекулы озона с равным основанием можно описать схемой Б, С позиций метода наложения валентных схем (см. § 44) это означает, что в действительности структура молекулы озона является промежуточной между схемами А и Б и ее можно представить в форме:
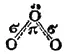
Здесь пунктирные линии указывают на делокализацию π-электронной пары, т. е. на принадлежность ее всем трем атомам кислорода. Следовательно, π-связь в молекуле озона — трехцентровая.
Рассмотрение строения молекулы озона с позиций метода МО также приводит к выводу об образовании здесь трехцентровои связывающей молекулярной π-орбитали.
Озон — один из сильнейших окислителей. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов — в их сульфаты. В ходе большинства этих реакций молекула озона теряет один атом кислорода, переходя в молекулу O 2.
Из раствора иодида калия озон выделяет иод:
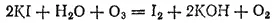
Если поместить в воздух, содержащий озон, бумажку, смоченную растворами KI и крахмала, то она тотчас же синеет. Этой реакцией пользуются для открытия озона.
Как сильный окислитель озон убивает бактерии и потому применяется для обеззараживания воды и для дезинфекции воздуха.
Озон ядовит. Предельно допустимым является его содержание в воздухе, равное 10 -5%. При этой концентрации хорошо ощущается его запах. В приземном слое атмосферы содержание озона обычно лежит в пределах 10 -7-10 -6% он образуется в атмосфере при электрических разрядах.
- 367 -
126. Сера в природе. Получение серы.
Сера (Sulfur) встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. В Советском Союзе залежи самородной серы находятся в Туркмении в пустыне Кара-Кум, в Узбекской ССР, по берегам Волги. За рубежом наиболее крупные месторождения серы находятся в США, Италии и Японии.
Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu 2S) и служат источником получения цветных металлов.
Из соединений серы в природе распространены также сульфаты, главным образом, кальция и магния. Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы в земной коре составляет приблизительно 0,1%.
Самородная сера содержит посторонние вещества, для отделения которых пользуются способностью серы легко плавиться. Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую ее очистку производят перегонкой в рафинировочных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера прямо переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°C, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Важным источником получения серы служит железный колчедан FeS 2, называемый также пиритом, и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
127. Свойства и применение серы.
При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112.8°C; плотность ее 2,07 г/см 3. Она нерастворима в воде, но довольно хорошо растворяется в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис. 112). Эта модификация серы называется ромбической.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрытыми изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы (рис. 113). Эта модификация серы называется моноклинной. Она имеет плотность 1.96 г/см 3, плавится при 119.3°C и устойчива только при температуре выше 96°C.
- 368 -
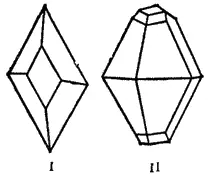
Рис. 112. Кристаллы ромбической серы (I и II).

Рис. 113. Кристалл моноклинной серы (III).
При более низкой температуре кристаллы моноклинной серы светлеют, превращаясь в октаэдры ромбической серы.
Определение молекулярной массы серы по понижению температуры замерзания ее растворов в бензоле приводит к заключению, что молекулы серы состоят из восьми атомов (S 8). Из таких же молекул S 8, имеющих кольцевое строение, построены кристаллы ромбической и моноклинной серы. Таким образом, различие в свойствах кристаллических модификаций серы обусловлено не различным числом атомов в молекулах (как, например, в молекулах кислорода и озона), а неодинаковой структурой кристаллов.
Интересны изменения, которые претерпевает сера, если медленно нагревать ее до кипения. При 112.8°C она плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании жидкость темнеет, приобретая красновато-бурый цвет, и при температуре около 250°C становится настолько вязкой, что не выливается из опрокинутого сосуда. Выше 300°C жидкая сера снова становится подвижной, но цвет ее остается таким же темным. Наконец, при 444.6°C сера закипает, образуя оранжево-желтые пары. При охлаждении те же явления повторяются в обратном порядке.
Описанные изменения имеют следующее объяснение. При температурах, превышающих 150-160°C, кольцевые молекулы серы S 8начинают разрываться. Образующиеся цепочки атомов соединяются друг с другом — получаются длинные цепи, вследствие чего вязкость расплава сильно увеличивается. Дальнейшее нагревание приводит к разрыву этих цепей, и вязкость серы вновь снижается.
Читать дальшеИнтервал:
Закладка:








