Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
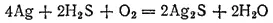
При взбалтывании раствора какого-нибудь сульфида, например сульфида натрия, с серой последняя растворяется в нем, и после выпаривания получается остаток, содержащий, кроме сульфида натрия, также соединения с большим содержанием серы — от Na 2S 2до Na 2S 5. Такие соединения называются полисульфидами или многосернистыми металлами.
Среди сульфидов имеется много соединений переменного состава. Например, сульфид железа(II) может иметь состав от FeS 1.01до FeS 1.14.
Природные сульфиды составляют основу руд цветных и редких металлов и широко используются в металлургии. Некоторые из них служат также сырьем для получения серной кислоты. В этих же целях используется и природный полисульфид — железный колчедан (пирит) FeS 2(см. пп. 126 и 129). Сульфиды щелочных и щелочноземельных металлов находят применение в химической и в легкой промышленности. Так, Na 2S, CaS и BaS применяются в кожевенном производстве для удаления волосяного покрова с кож. Сульфиды щелочноземельных металлов, цинка и кадмия служат основой люминофоров (см. стр. 604). Некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике.
129. Диоксид серы. Сернистая кислота.
Диоксид (двуокись) серы SO 2образуется при сжигании серы в воздухе или кислороде. Он получается также при прокаливании на воздухе («обжигании») сульфидов металлов, например железного колчедана:
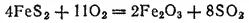
По этой реакции диоксид серы получают обычно в промышленности (о других промышленных способах получения SO 2см, 9 § 131).
- 372 -
Диоксид серы — бесцветный газ («сернистый газ») с резким запахом горячей серы. Он довольно легко конденсируется в бесцветную жидкость, кипящую при -10.0°C. При испарении жидкого SO 2происходит сильное понижение температуры (до -50°C).
Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20°C ); при этом частично происходит реакция с водой и образуется сернистая кислота:
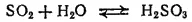
Таким образом, диоксид серы является ангидридом сернистой кислоты. При нагревании растворимость SO 2уменьшается и равновесие смещается влево; постепенно весь диоксид серы снова выделяется из раствора.
Молекула SO 2построена аналогично молекуле озона. Ядра составляющих ее атомов образуют равнобедренный треугольник:
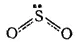
Здесь атом серы, как и центральный атом кислорода в молекуле озона, находится в состоянии sp 2-гибридизации и угол OSO близок к 120°. Ориентированная перпендикулярно к плоскости молекулы p z-орбиталь атома серы не участвует в гибридизации. За счет этой орбитали и аналогично ориентированных p z-орбиталей атомов кислорода образуется трехцентровая π-связь; осуществляющая ее пара электронов принадлежит всем трем атомам молекулы.
Диоксид серы применяют для получения серной кислоты, а также (в значительно меньших количествах) для беления соломы, шерсти, шелка и как дезинфицирующее средство (для уничтожения плесневых грибков в подвалах, погребах, винных бочках, бродильных чанах).
Сернистая кислота H 2SO 3— очень непрочное соединение. Она известна только в водных растворах. При попытках выделить сернистую кислоту она распадается на SO 2и воду. Например, при действии концентрированной серной кислоты на сульфит натрия вместо сернистой кислоты выделяется диоксид серы:
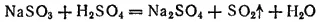
Раствор сернистой кислоты необходимо предохранять от доступа воздуха, иначе она, поглощая из воздуха кислород, медленно окисляется в серную кислоту:
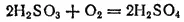
Сернистая кислота — хороший восстановитель. Например, свободные галогены восстанавливаются ею в галогеноводороды:
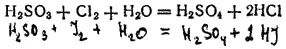
- 373 -
Однако при взаимодействии с сильными восстановителями сернистая кислота может играть роль окислителя. Так, реакция ее с сероводородом в основном протекает согласно уравнению:
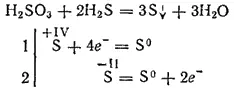
Будучи двухосновной (K 1≈ 2·10 -2, K 2= 6.3·10 -8), сернистая кислота образует два ряда солей. Средние ее соли называются сульфитами, кислые — гидросульфитами.
Как и кислота, сульфиты и гидросульфиты являются восстановителями. При их окислении получаются соли серной кислоты.
Сульфиты наиболее активных металлов при прокаливании разлагаются с образованием сульфидов и сульфатов (реакция самоокисления - самовосстановления):
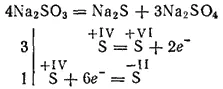
Сульфиты калия и натрия применяются для отбеливания некоторых материалов, в текстильной промышленности при крашении тканей, в фотографии. Раствор Ca(HSO 3) 2(эта соль существует только в растворе) применяется для переработки древесины в так называемую сульфитную целлюлозу, из которой потом получают бумагу.
130. Триоксид серы. Серная кислота.
Диоксид серы может присоединять кислород, переходя при этом в триоксид (трехокись) серы. При обычных условиях эта реакция протекает чрезвычайно медленно. Гораздо быстрее и легче она проходит при повышенной температуре в присутствии катализаторов.
Триоксид серы представляет собой бесцветную легкоподвижную жидкость плотностью 1,92 г/см 3, кипящую при 44.7°C и кристаллизующуюся при 16.8°C. При хранении, особенно в присутствии следов влаги, это вещество видоизменяется, превращаясь в длинные шелковистые кристаллы.
Свободные молекулы SO 3(в газообразном состоянии) построены в форме правильного треугольника, в центре которого находится атом серы, а в вершинах — атомы кислорода. Как и в молекуле SO 2, атом серы находится здесь в состоянии sp 2-гибридизации; в соответствии с этим ядра всех четырех атомов, входящих в состав молекулы SO 3, расположены в одной плоскости, а валентные углы OSO равны 120°C:
- 374 -
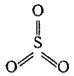
Атом серы в молекуле SO 3связан с атомами кислорода тремя двухцентровыми о-связями и одной четырехцентровой π-связью (ср. со структурой молекулы SO 2§ 129). Кроме того, за счет неподеленных 2p-электронных пар атомов кислорода и свободных 3d-орбиталей атома серы здесь возможно образование дополнительных ковалентных связей, подобно тому, как это имеет место в молекуле Cl 2(стр. 341).
Читать дальшеИнтервал:
Закладка:








