Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Серная кислота — один из важнейших продуктов основной химической промышленности; к последней относится производство кислот, щелочей, солей, минеральных удобрений и хлора. Основным потребителем серной кислоты является производство минеральных удобрений. Она служит также для получения многих других кислот, применяется в большом количестве в органическом синтезе, при производстве взрывчатых веществ, для очистки керосина, нефтяных масел и продуктов коксохимической промышленности (бензола, толуола), при изготовлении красок, травлении черных металлов (снятие окалины).
До Октябрьской революции производство серной кислоты в России было ничтожным по сравнению с производством ее в других странах. Продукция всех заводов составляла в 1913 г всего около 145 тыс. т.
После революции положение резко изменилось. Старые заводы были расширены и заново переоборудованы. Была создана отечественная сырьевая база для сернокислотной промышленности и построен ряд новых заводов. Это позволило значительно увеличить производство серной кислоты;

- 380 -
132. Пероксодвусерная кислота.
При электролизе 50% раствора серной кислоты на катоде разряжаются ионы водорода, а на аноде HSO 4 -. Последние, теряя свои заряды, соединяются попарно и образуют пероксодвусерную, или надсерную, кислоту H 2S 2O 8:
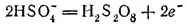
Пероксодвусерная кислота является производным пероксида водорода и промежуточным продуктом при получении последней электрохимическим путем (см. § 117). Строение ее можно выразить формулой:
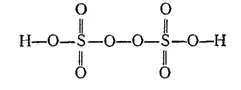
Как и в пероксиде водорода, два атома кислорода связаны здесь ковалентной связью, образуя «цепочку», характерную для пероксидов. Такие кислоты получили общее название пероксокислот (надкислот) и, кроме серы, известны для ряда других элементов. Изучением пероксокислот много занимался Л. В. Писаржевский, которому химия обязана классическими исследованиями в этой области.
Все пероксокислоты обладают, подобно пероксидам, сильными окислительными свойствами.
Соли пероксодвусерной кислоты — пероксод и сульфаты — применяются для некоторых технических целей, как средство для отбелки и в качестве окислителей в лабораторной практике.
133. Тиосерная кислота.
Если прокипятить водный раствор сульфита натрия Na 2SO 3с серой и, отфильтровав излишек серы, оставить охлаждаться, то из раствора выделяются бесцветные прозрачные кристаллы нового вещества, состав которого выражается формулой Na 2S 2O 3·5H 2O. Это вещество — натриевая соль тиосерной кислоты Na 2S 2O 3**. Структурная формула тиосерной кислоты имеет следующий вид:
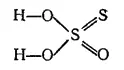
Тиосерная кислота неустойчива. Уже при комнатной температуре она распадается. Значительно устойчивее ее соли — тиосульфаты. Из них наиболее употребителен тиосульфат натрия Na 2S 2O 3·5H 2O, известный также под неправильным названием «гипосульфит».
** Вещества, которые можно рассматривать как получающиеся из кислородосодержащих кислот путем замещения в них всего части кислорода серой, называются тиокислотами, а соотсветствующие им соли-тиосолями. В частности, тиосерную кислоту можно представить как серную кислоту в молекуле которой вместо одного из атомов кислорода находится атом серы. поэтому для H 2S 2O 3принято название "тиосерная кислота".
- 381 -
При добавлении к раствору тиосульфата натрия какой-нибудь кислоты, например соляной, появляется запах диоксида серы и через некоторое время жидкость становится мутной от выделившейся серы.
По-видимому, вначале образуется тиосерная кислота
Na 2S 2O 3+ 2HCl = H 2S 2O 3+ 2NaCl
которая далее разлагается согласно уравнению:
H 2S 2O 3= H 2O + SO 2↑ + S↓
Изучение свойств тиосульфата натрия приводит к выводу, что атомы серы, входящие в его состав, имеют различную окисленность: у одного из них степень окисленности +4, у другого 0.
Тиосульфат натрия — восстановитель. Хлор, бром и другие сильные окислители окисляют его до серной кислоты или до ее соли. Например:
Na 2S 2O 3+ 4Cl 2+ 5H 2O = 2H 2SO 4+ 2NaCl + 6HCl
Иначе протекает окисление тиосульфата натрия менее сильными окислителями. Под действием, например, иода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2S 4O 6:
I 2+2Na 2S 2O 3= 2NaI + Na 2S 4O 6
Эта реакция служит основой одного из методов количественного химического анализа (иодометрип), с помощью которого определяют содержание некоторых окислителей и восстановителей.
Тетратноповая кислота H 2S 4O 6принадлежит к группе политноновых кислот. Это двухосновные кислоты общей формулы H 2S xO 6, где x может принимать значения от 2 до 6, а возможно и больше. Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли политионовых кислот — политионаты — более устойчивы; некоторые из них получены в виде кристаллов.
Тиосульфат натрия применяется в фотографии как закрепитель (см. стр. 561), в текстильной промышленности для удаления остатков хлора после отбелки тканей, в медицине, в ветеринарии.
134. Соединения серы с галогенами.
При пропускании хлора через расплавленную серу образуется хлорид серы(I) (или хлористая сера), представляющий собой жидкость, кипящую при 137. Молекулярная масса этого вещества, как показывает плотность его пара, отвечает формуле S 2Cl 2.
Хлорид серы(I) растворяет в себе серу в количестве до 66%. Вода разлагает S 2Cl 2с образованием диоксида серы, хлороводорода и сероводорода:
S 2Cl 2+2H 2O = SO 2+ H 2S + 2HCl
Хлорид серы(I) применяется для вулканизации каучука.
Известны еще два соединения серы с хлором SCl 2и SCl 4, не имеющие практического значения. С фтором сера образует газообразный фторид серы(VI) SF 6, с бромом — бромид серы(I) S 2Br 2.
- 382 -
135. Селен (Selenium). Теллур (Tellurium).
Селен мало распространен в природе. В земной коре содержание селена составляет 0,00006% (масс.). Его соединения встречаются в виде примесей к природным соединениям серы с металлами (PbS, FeS 2и др.). Поэтому селен получают из отходов, образующихся при производстве серной кислоты, при электролитическом рафинировании меди и при некоторых других процессах.
Теллур принадлежит к числу редких элементов: содержание его в земной коре составляет всего 0,000001% (масс.).
В свободном состоянии селен, подобно сере, образует несколько аллотропических видоизменений, из которых наиболее известны аморфный селен, представляющий собой красно-бурый порошок, и серый селен, образующий хрупкие кристаллы с металлическим блеском.
Читать дальшеИнтервал:
Закладка:








