Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Азот — бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Молекулярный азот — химически малоактивное вещество. При комнатной температуре он взаимодействует лишь с литием. Малая активность азота объясняется большой прочностью его молекул, обусловливающей высокую энергию активации реакций, протекающих с участием азота. Однако при нагревании он начинает реагировать со многими металлами — с магнием, кальцием, титаном. С водородом азот вступает во взаимодействие при высоких температуре и давлении в присутствии катализатора. Реакция азота с кислородом начинается при 3000-4000°C.
Животные, помещенные в атмосферу азота, быстро погибают, но не вследствие ядовитости азота, а из-за отсутствия кислорода.
Основное применение азот находит в качестве исходного продукта для синтеза аммиака и некоторых других соединений. Кроме того, он применяется для заполнения электрических ламп, для создания инертной среды при промышленном проведении некоторых химических реакций, при перекачке горючих жидкостей.
137. Аммиак. Соли аммония.
Азот образует несколько соединений с водородом; из них наибольшее значение имеет аммиак — бесцветный газ с характерным резким запахом (запах «нашатырного спирта»).
В лаборатории аммиак обычно получают, нагревая хлорид аммония NH 4Cl с гашеной известью Ca(OH) 2. Реакция выражается уравнением
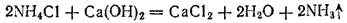
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
- 386 -
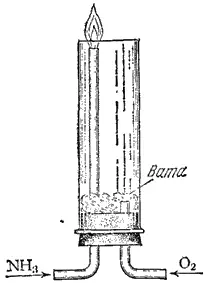
Рис. 114. Прибор для демонстрации горения аммиака в кислороде.
Масса 1 л аммиака при нормальных условиях равна 0,77 г. Поскольку этот газ значительно легче воздуха, то его можно собирать в перевернутые вверх дном сосуды.
При охлаждении до -33.4°C аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при -77.8°C.
Электронная структура и пространственное строение молекулы аммиака рассмотрены в § 43. В жидком аммиаке молекулы NH 3(μ=1.48D) связаны между собой водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака (-33,4°C), не соответствующую его малой молекулярной массе (17).
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH 3и имеет плотность 0,91 г/см 3. Раствор аммиака в воде иногда называют нашатырным спиртом. Обычный медицинский нашатырный спирт содержит 10% NH 3. С повышением температуры, растворимость аммиака уменьшается, поэтому он выделяется при нагревании из концентрированного раствора, чем иногда пользуются в лабораториях для получения небольших количеств газообразного аммиака.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH 3·H 2O, плавящийся при — -79°C. Известен также кристаллогидрат состава 2NH 3·H 2O. В этих гидратах молекулы воды и аммиака соединены между собой водородными связями.
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. В аммиаке азот имеет самую низкую степень окисленности (-3). Поэтому аммиак обладает только восстановительными свойствами. Если пропускать ток NH 3по трубке, вставленной в другую широкую трубку (рис. 114), по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
4NH 3+ 3O 2= 6H 2O + 2N 2
При других условиях аммиак может окисляться до оксида азота NO (см. § 143).
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не обладает кислотными свойствами. Однако атомы водорода в его молекуле могут замещаться атомами металлов.
- 387 -
При полном замещении водорода металлом образуются соединения, называемые нитридами. Некоторые из них, например нитриды кальция и магния, получаются при непосредственном взаимодействии азота с металлами при высокой температуре;
3Mg + N 2= Mg 3N 2
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла. Например:
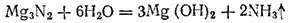
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH 2в виде бесцветных кристаллов:
2NH 6+ 2Na = 2NaNH 2+ H 2
Вода разлагает амид натрия;
NaNH 2+ H 2O = NaOH + NH 3↑
Обладая сильными основными и водоотнимающими свойствами, амид натрия нашел применение при некоторых органических синтезах, например, в производстве красителя индиго и некоторых лекарственных препаратов.
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот, NCl 3
NH 4Cl + 3Cl 2= NCl 3+ 4HCl
в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (иодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета.
С фтором азот образует устойчивый фторид азота NF 3.
Из данных табл. 6 (стр. 118) видно, что электроотрицательность хлора и пода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях NCl 3и NI 3степень окисленности азота равна —3, а в NF 3она равна +3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою NCl 3или NI 3образуется аммиак, а в случае NF 3получается оксид азота (III);
NCl 3+ 3H 2O = NH 3+ 3HOCl
2NF 3+ 3H 2O = N 2O 3+ 6HF
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную электронную пару:
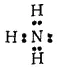
Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно-акцепторному способу четвертой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами.
- 388 -
Этим объясняется чрезвычайно характерная для аммиака способность вступать в реакции присоединения.
Примеры сложных (комплексных) соединений, образуемых аммиаком в результате реакций присоединения, приведены в §§ 200 и 201, а также в гл. XVIII. Выше (стр. 124) уже было рассмотрено взаимодействие молекулы NH 3с ионом водорода, приводящее к образованию иона аммония NH 4 +:
Читать дальшеИнтервал:
Закладка:








