Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 377 -
В сельском хозяйстве разбавленным раствором медного купороса пользуются для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Железный купорос FeSO 4·7H 2O- см. стр. 668.
Квасцы. Если к раствору сульфата алюминия Al 2(SO 4) 3прибавить раствор сульфата калия K 2SO 4и оставить жидкость кристаллизоваться, то из нее выделяются красивые бесцветные кристаллы состава K 2SO 4·Al 2(SO 4) 3·24H 2O или KAl(SO 4) 2·12H 2O. Это алюмокалиевые квасцы — двойная соль серной кислоты и металлов калия и алюминия*.
* О применении алюмокалиевых квасцов см. стр. 618
Двойные соли существуют только в твердом виде. Раствор алюмокалиевых квасцов в воде содержит ионы K +, Al 3+и SO 4 2-.
Вместо алюминия в состав квасцов могут входить другие трехвалентные металлы — железо, хром, а вместо калия — натрий или аммоний. Например, хромокалиевые квасцы имеют состав K 2SO 4·Cr(SO 4) 3·24H 2O.
Двусерная кислота. Олеум. Раствор триоксида серы в серной кислоте называется олеумом. Он широко применяется в промышленности, например, для очистки нефтепродуктов, для производства некоторых красителей, взрывчатых веществ.
В олеуме часть молекул SO 3соединяется с серной кислотой. При этом получается двусерная, или пиросерная, кислота H 2S 2O 7:
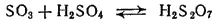
При охлаждении олеума двусерная кислота выделяется в виде бесцветных кристаллов.
Соли пиросернон кислоты — дисульфаты или пиросульфаты получаются нагреванием гидросульфатов. Например:
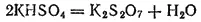
При нагревании выше температуры плавления дисульфаты разлагаются с выделением SO 3, переходя в сульфаты:
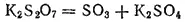
131. Получение и применение серной кислоты.
В промышленности серная кислота получается окислением диоксида серы SO 2до триоксида с последующим взаимодействием SO 3с водой.
Необходимый для производства кислоты диоксид серы получают в технике различными способами. Наиболее распространенным из них является обжиг железного колчедана при доступе воздуха (см. § 129).
В СССР вместо пирита обжигу преимущественно подвергают флотационный колчедан — продукт флотации (см. § 192) медных руд с низким содержанием меди — и углистый колчедан, получаемый при обогащении каменных углей с высоким содержанием серы.
- 378 -
Образующийся при обжиге колчедана оксид железа(III) («колчеданный огарок») удаляется из печей и может быть, использован для получения железа, а смесь диоксида серы с кислородом и азотом воздуха пропускается через очистительные аппараты, в которых она освобождается от пыли и других примесей.
Диоксид серы получают также сжиганием серы. В этом случае образуется газ, свободный от вредных примесей; поэтому отпадает необходимость в очистительных аппаратах, что значительно упрощает производство серной кислоты.
Важным источником получения диоксида серы служат отходящие газы заводов цветной металлургии. Значение этого источника видно хотя бы из того, что при выплавке 1 т меди образуется 7,5 т SO 2, из которого можно получить более 10 т серной кислоты.
Большое количество SO 2извлекают из топочных газов, особенно получаемых при сжигании каменного угля, содержащего много серы.
Сырьем для получения SO 2служит также гипс CaSO 4·2H 2O и ангидрит CaSO 4. Эти минералы при 1350-1400°C разлагаются с образованием SO 2:
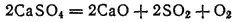
Если прокаливать гипс, смешанный в необходимой пропорции с оксидом железа(III) Fe 2O 3, оксидом алюминия Al 2O 3и кремнеземом SiO 2, то одновременно с диоксидом серы получается цемент.
При получении серной кислоты SO 2окисляют двумя методами: контактным и нитрозным.
Контактный метод основан на присоединении кислорода к диоксиду серы при соприкосновении (контакте) этих газов с катализатором. Обязательным условием успешного протекания процесса является полное удаление примесей из реакционных газов, так как даже ничтожные следы некоторых веществ (соединений мышьяка, фосфора и др.) «отравляют» катализатор, вызывая быструю потерю им своей активности.
В качестве катализатора для окисления SO 2применяют ванадиевый ангидрид V 2O 5.
При получении серной кислоты контактным методом смесь диоксида серы и воздуха после освобождения от примесей проходит через подогреватель, обогреваемый выходящими из контактного аппарата газами, и поступает в контактный аппарат. На катализаторе происходит окисление SO 2в SO 3, сопровождающееся выделением значительного количества теплоты:
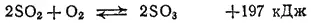
Увеличение содержания кислорода в смеси повышает выход SO 3, смещая равновесие вправо. При 450°C и избытке кислорода степень превращения SO 2в SO 3достигает 95-97%.
Образовавшийся в контактном аппарате триоксид серы пропускают в 96—98 %-ную серную кислоту, которая, насыщаясь SO 3, превращается в олеум.
В России производство серной кислоты по контактному методу впервые было осуществлено на Тентелевском заводе (ныне завод «Красный химик») в Петербурге.
- 379 -
Разработанная химиками этого завода «тентелевская система» была одной из самых совершенных систем своего времени и получила мировую известность. По этой системе были построены контактные установки в ряде стран, в том числе в Японии и США.
Нитрозный метод. Контактный метод получения серной кислоты стал применяться сравнительно недавно. До этого серную кислоту получали исключительно нитрозным методом, сущность которого заключается в окислении диоксида серы диоксидом азота NO 2в присутствии воды.
Газообразный диоксид азота реагирует с диоксидом серы согласно уравнению:
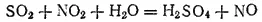
Отдавая диоксиду серы часть кислорода, NO 2превращается в другой газ — оксид NO. Последний взаимодействует с кислородом воздуха, в результате чего вновь образуется диоксид азота
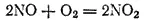
который идет на окисление новых порций SO 2.
Таким образом, при производстве серной кислоты NO служит по существу катализатором, ускоряющим процесс окисления диоксида серы.
Промышленность выпускает несколько сортов серной кислоты. Они различаются между собою концентрацией, а также содержанием примесей. Большая часть производимой кислоты имеет плотность 1,825-1,84 г/см 3, что соответствует массовой доле H 2SO 4от 91 до 94%.
Читать дальшеИнтервал:
Закладка:








