Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Если расплавленную серу, нагретую до кипения, вылить тонкой струей В холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити. Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую.
В парах серы с увеличением температуры число атомов в молекуле постепенно уменьшается: S 8-S 6-S 4-S 2-S. При 800-1400°C пары серы состоят главным образом из молекул S 2, при 1700°C — из атомов.
Сера — типичный неметалл. Со многими металлами, например с медью, железом, цинком, сера соединяется непосредственно с выделением большого количества теплоты. Она соединяется также почти со всеми неметаллами, но далеко не так легко и энергично, как с металлами.
- 369 -
Сера широко используется в народном хозяйстве. В резиновой промышленности ее применяют для превращения каучука в резину; своп ценные свойства каучук приобретает только после смешивания с серой и нагревания до определенной температуры. Такой процесс называется вулканизацией каучука (стр. 488). Каучук с очень большим содержанием серы называют эбонитом; это хороший электрический изолятор.
В виде серного цвета серу используют для уничтожения некоторых вредителей растений. Она применяется также для приготовления спичек, ультрамарина (синяя краска), сероуглерода и ряда других веществ. В странах, богатых серой, она служит сырьем для получения серной кислоты.
128. Сероводород. Сульфиды.
При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.
Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
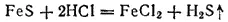
Сероводород — бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха, сжижается при -60,3°C и затвердевает при -85,6°C. На воздухе сероводород горит голубоватым пламенем, образуя диоксид серы и воду:
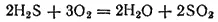
Если внести в пламя сероводорода какой-нибудь холодный предмет, например фарфоровую чашку, то температура пламени значительно понижается и сероводород окисляется только до свободной серы, оседающей на чашке в виде желтого налета:
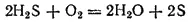
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Сероводород очень ядовит. Длительное вдыхание воздуха, содержащего этот газ даже в небольших количествах, вызывает тяжелые отравления.
При 20°C один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой. При стоянии на воздухе, особенно на свету, сероводородная вода скоро становится мутной от выделяющейся серы. Это происходит в результате окисления сероводорода кислородом воздуха (см. предыдущую реакцию). Раствор сероводорода в воде обладает свойствами кислоты.
Сероводород — слабая двухосновная кислота. Она диссоциирует ступенчато и в основном по первой ступени:
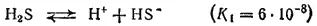
- 370 -
Диссоциация по второй ступени
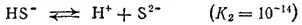
протекает в ничтожно малой степени.
Сероводород — сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, pH раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
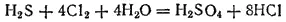
Сероводород встречается в природе в вулканических газах и в водах минеральных источников. Кроме того, он образуется при разложении белков погибших животных и растений, а также при гниении пищевых отбросов.
Средние соли сероводорода называются сульфидами. Их можно получать различными способами, в том числе непосредственным соединением металлов с серой. Смешав, например, железные опилки с порошком серы и нагрев смесь в одном месте, можно легко вызвать реакцию железа с серой, которая дальше идет сама и сопровождается выделением большого количества теплоты;

Многие сульфиды молено получить, действуя сероводородом на растворимые в воде соли соответствующих металлов. Например, при пропускании сероводорода через раствор какой-нибудь соли меди(II) появляется черный осадок сульфида меди(II)
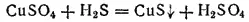
или в ионно-молекулярной форме:
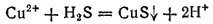
Несмотря на то, что в ходе реакции получается кислота, CuS выпадает в осадок: сульфид меди не растворяется ни в воде, ни в разбавленных кислотах. Но при действии сероводорода на раствор какой-либо соли железа (II) осадка не получается — сульфид железа (II) нерастворим в воде, но растворяется в кислотах. Это различие обусловлено тем, что произведение растворимости CuS много меньше произведения растворимости FeS (см. табл. 16 на стр. 242). О взаимодействии сульфидов металлов с кислотами более подробно говорится в § 91.
Некоторые сульфиды растворимы в воде, например, Na 2S и K 2S. Понятно, что они не могут быть получены из солей соответствующих металлов действием сероводорода или других сульфидов.
- 371 -
Различиями в растворимости сульфидов пользуются в аналитической химии для последовательного осаждения металлов из растворов их солей.
Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу. Например, Na 2S при растворении в воде почти целиком гидролизуется с образованием кислой соли — гидросульфида натрия:
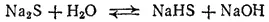
или
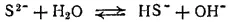
Серебряные и медные предметы чернеют в воздухе и в воде, содержащих сероводород. Это происходит оттого, что они покрываются налетом соответствующего сульфида. При этом окислителем служит кислород, находящийся в воздухе или растворенный в воде:
Читать дальшеИнтервал:
Закладка:








