Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
На рис. 108 схематически изображена часть молекулы гидроксида Э(OH) n, составленная из n-зарядного иона Э n+, иона кислорода O 2-и иона водорода (протона) H +. Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи Э-О (в результате чего отщепляется OH-), либо с разрывом связи O-H (что приводит к отщеплению иона H+); в первом случае гидроксид будет проявлять свойства основания, во втором — свойства кислоты.
Каждый из возможных путей диссоциации гидроксида будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени окисленности элемента Э увеличится заряд иона Э n+, что усилит его притяжение к иону O 2-и тем самым затруднит диссоциацию гидроксида по типу основания.
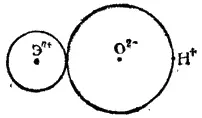
Рис. 108. Ионная схема фрагмента молекулы гидроксида Э(OH) n
- 358 -
Вместе с тем усилится взаимное отталкивание одноименно заряженных ионов Э n+и H +, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисленности элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
Увеличение радиуса иона Э n+при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов O 2-и H +. В результате взаимное электростатическое притяжение ионов Э n+и O 2-станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов Э n+и H +, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого этим элементом гидроксида. Примером проявления этой закономерности может служить изменение констант кислотной диссоциации в ряду HOCl(K=5·10 -8)-HOBr (K=2·10 -9) - HOI (K=2·10 -10).
Разумеется, предположение о чисто ионной природе химических связей в молекулах гидроксидов является весьма грубым. В действительности связь O-H имеет преимущественно ковалентный характер, а связь Э-O можно считать близкой к ионной только для щелочных металлов. Кроме того, изложенная трактовка кислотно-основных свойств гидроксидов не учитывает особенностей взаимодействия ионов ЭO -, H +, Э n+и OH -с молекулами растворителя (воды). Поэтому рассмотренная схема влияния заряда и размеров иона Э n+на характер диссоциации молекулы Э(OH) nне может служить основой для количественной оценки кислотноосновных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных состояниях его окисленности, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
Кислородные соединения брома и иода. Растворы бромноватистой (НОВг) и иодноватистой (HOI) кислот могут быть получены, подобно хлорноватистой кислоте, взаимодействием соответствующих галогенов с водой
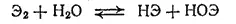
причем в ряду Cl 2- Br 2- I 2равновесие все в большей степени смещается влево.
При переходе от HOCl к НОВг и HOI устойчивость и окислительная активность кислот уменьшаются. По этому же ряду ослабляются и кислотные свойства (см. выше). Иодноватистая кислота HOI является уже амфотерным соединением, у которого основные свойства несколько преобладают над кислотными.
Бромноватую (HBrO 3) и йодноватую (HIO 3) кислоты можно получить путем окисления бромной или йодной воды хлором:
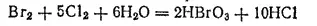
- 359 -
Бромноватая кислота очень похожа по свойствам на HClO 3, а окислительные и кислотные свойства HIO 3выражены значительно слабее.
Иодноватая кислота представляет собой бесцветные кристаллы, вполне устойчивые при комнатной температуре. При осторожном нагревании ее до 200°C можно получить порошок оксида иода(V), или йодноватого ангидрида — I 2O 5:
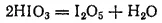
Йодноватый ангидрид проявляет окислительные свойства, а при нагревании выше 300°C распадается на иод и кислород.
До недавнего времени считали, что бром не образует соединений, в которых его степень окисленности равна семи. Однако в 1968 г. путем окисления KBrO 3были получены перброматы и соответствующая им бромная кислота HBrO 4. Наилучшим окислителем оказался XeF 2:
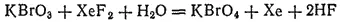
О свойствах бромной кислоты и ее солей пока известно мало. Напротив, йодная кислота (HIO 4) и ее соли (периодаты) хорошо изучены.
Сама кислота может быть получена действием иода на HClO 4
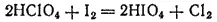
или электролизом раствора HIO 3:
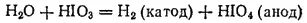
Из раствора йодная кислота выделяется в виде бесцветных кристаллов, имеющих состав HIO 4·2H 2O. Этот гидрат следует рассматривать как пятиосновную кислоту H 5IO 6(ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag 5IO 6). Йодная кислота — слабая, но более сильный окислитель, чем HClO 4.
Оксид иода (VII) I 2O 7не получен.
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
Элементы главной подгруппы шестой группы периодической системы это кислород, сера, селен, теллур и полоний. Последний из них — радиоактивный металл; известны как природные, так и искусственно полученные его изотопы.
Во внешней электронной оболочке атомы рассматриваемых элементов содержат шесть электронов — два на p-орбитали и четыре на р-орбитали. Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое:
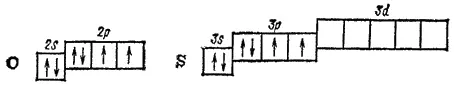
Как указывалось в § 41, такая электронная структура атома кислорода обусловливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода, как правило, равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленнымн электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному способу.
Читать дальшеИнтервал:
Закладка:








