Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Хлорид ртути(II) HgCl 2, или сулема, очень сильный яд. Разбавленные растворы сулемы (1:1000) используются в медицине как сильнодействующее дезинфицирующее средство (см. также стр. 607).
Хлорид серебра AgCl — наименее растворимая соль соляной кислоты. Образование осадка AgCl при взаимодействии ионов Cl- с ионами Ag+ служит характерной реакцией на хлорид-ионы. Хлорид серебра применяют в фотографической промышленности при изготовлении светочувствительных материалов.
Бромоводород и иодоводород очень похожи по своим свойствам на хлороводород, но отличаются более выраженными восстановительными свойствами. Молекулярный кислород постепенно окисляет иодоводород уже при комнатной температуре, причем под действием света реакция сильно ускоряется:
4HI + O 2= 2I 2+2H 2O
Бромоводород взаимодействует с кислородом гораздо медленнее, в то время как при обычных условиях соляная кислота вовсе с ним не взаимодействует.
Восстановительные свойства бромоводорода и иодоводорода заметно проявляются и при взаимодействии с концентрированной серной кислотой. При этом HBr восстанавливает H 2SO 4до SO 2:
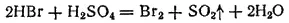
а HI — до свободной серы или даже до H 2S:
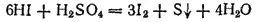
или
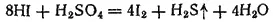
Поэтому HBr трудно, a HI практически невозможно получить действием серной кислоты на бромиды или иодиды. Обычно эти галогеноводороды получают действием воды на соединения брома и иода с фосфором — PBr 3и PI 3. Последние подвергаются при этом полному гидролизу, образуя фосфористую кислоту и соответствующий галогеноводород:
PBr 3+ 3H 2O = H 3PO 3+ 3HBr
PI 3+ 3H 2O = H 3PO 3+ 3HI
Раствор иодоводорода (вплоть до 50%-ной концентрации) можно получить, пропуская H 2S в водную суспензию иода. Реакция идет согласно схеме:
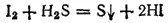
- 353 -
Соли бромоводорода и иодоводорода называются соответственно бромидами и йодидами. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
Растворы бромидов натрия и калия под химически неправильным названием «бром» применяются в медицине как успокаивающее средство при расстройствах нервной системы. Бромид серебра в больших количествах идет на изготовление фотоматериалов. Иодид калия применяют в медицине — в частности, при заболеваниях эндокринной системы.
122. Кислородсодержащие соединения галогенов.
Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом и могут быть получены только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования (см., например, в табл. 7 на стр. 194 значения ΔG° 298для ClO 2, Cl 2O, Cl 2O 7и OF 2).
Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисленности, достигающую семи.
Фторид кислорода OF 2можно получить пропусканием фтора в охлажденный 2% раствор NaOH. Реакция идет согласно уравнению:
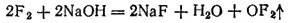
Помимо OF 2при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях OF 2— бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и водой
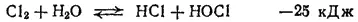
в результате которой образуются соляная кислота и хлорноватстая кислота HOOCl.
- 354 -
Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Получающиеся при гидролизе хлора HCl и HOCl могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно 1/3 растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Cl 2значительное количество соляной и хлорноватистой кислот.
Хлорноватистая кислота HOCl — очень слабая кислота ( K = 5·10 -8), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже).
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие в системе
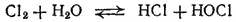
сдвигается вправо; реакция практически доходит до конца и получается раствор, содержащий соли хлорноватистой и соляной кислот:
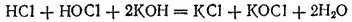
Тот же результат получится, если непосредственно пропускать хлор в холодный раствор щелочи
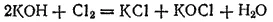
или в ионно-молекулярной форме:
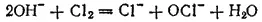
Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе, причем образуется хлорноватистая кислота:
Читать дальшеИнтервал:
Закладка:








