Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Очень энергично протекает взаимодействие фтора со сложными веществами. В его атмосфере горят такие устойчивые вещества, как стекло (в виде ваты) и водяной пар:
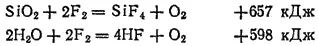
Интересно отметить, что при этом в качестве одного из продуктов горения образуется кислород.
Свободный хлор тоже проявляет очень высокую химическую активность, хотя и меньшую, чем фтор. Он непосредственно взаимодействует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Такие неметаллы, как фосфор, мышьяк, сурьма и кремний, уже при низкой температуре реагируют с хлором; при этом выделяется большое количество теплоты.
Энергично протекает взаимодействие хлора с активными металлами — натрием, калием, магнием и др.
При комнатной температуре без освещения хлор практически не взаимодействует с водородом, но при нагревании или на ярком солнечном свету реакция протекает по цепному механизму (см. § 62) со взрывом.
Химическая активность брома и иода меньше, чем хлора, но все же велика. Со многими металлами и неметаллами (например, с фосфором) они реагируют в обычных условиях. При этом бром по активности мало уступает хлору, а иод отличается от хлора значительно.
Взаимодействие брома с водородом происходит лишь при нагревании. Иод с водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная реакция — разложение иодоводорода:
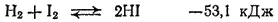
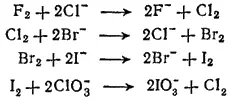
Сравнение химических свойств галогенов показывает, что их окислительная активность последовательно уменьшается от фтора к астату. Этот эффект проявляется в способности более легких галогенов в виде простых веществ окислять галогенид - ионы более тяжелых галогенов и в способности более тяжелых галогенов восстанавливать кислородные соединения более легких галогенов:
Несмотря на меньшую энергию сродства к электрону у фтора, чем у хлора (см. табл. 23), фтор является все же самым сильным окислителем среди галогенов. Объясняется это следующим. Превращение газообразного хлора или фтора в отрицательно заряженные ионы можно рассматривать как состоящее из двух стадий — диссоциации молекул на отдельные атомы

и присоединения электрона к образовавшемуся свободному атому галогена:
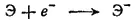
Первая стадия процесса требует затраты энергии на разрыв связей между атомами галогена в молекуле; мерой этих энергетических затрат может служить энтальпия диссоциации молекул галогена. У хлора, состоящего из более прочных молекул, энтальпия диссоциации в расчете на 1 моль атомов галогена (121,5 кДж/моль) значительно выше, чем у фтора (79,5 кДж/моль).
Вторая стадия процесса сопровождается выделением энергии (сродство к электрону); здесь выигрыш энергии в случае хлора (348,7 кДж/моль) несколько выше, чем в случае фтора (332,7 кДж/моль).
- 345 -
Как нетрудно подсчитать, общий выигрыш энергии в рассматриваемом процессе для фтора (253,2 кДж/моль) выше, чем для хлора (227,2 кДж/моль), что и характеризует фтор как более сильный окислитель.
Если реакция протекает в водном растворе, то следует учесть и энергию гидратации галогенид-ионов; при одинаковом заряде нона она тем выше, чем меньше радиус иона. Следовательно, при гидратации фторид-иона F- выделяется больше энергии, чем при гидратации иона Cl-, так что и в водных растворах фтор будет более сильным окислителем, чем хлор.
Аналогичные расчеты показывают, что при переходе от хлора к брому и иоду выигрыш энергии в окислительных процессах, протекающих в водных растворах с участием галогенов; также уменьшается. Этим и объясняется способность каждого галогена вытеснять более тяжелые галогены, находящиеся в степени окисленности —1, из растворов их соединений.
120. Получение и применение галогенов.
В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов. Это осуществляется или при помощи окислителей, или действием электрического тока.
Фтор, вследствие своей высокой электроотрицательности, может быть выделен из соединений только путем электролиза. Впервые он был получен в 1886 г. путем разложения электрическим током смеси безводного жидкого фтороводорода с KF. Этот метод применяется в настоящее время для промышленного получения фтора. Расплав состава KF+2HF (температура плавления 70°C) подвергают электролизу. Электролиз ведут в никелевом сосуде, который является катодом, а анодом служит уголь. Катодное и анодное пространства разделены диафрагмой для предотвращения взрыва при смешивании продуктов электролиза — водорода и фтора.
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлоридов натрия или калия. Хлор выделяется у анода, а у катода образуется соответственно гидроксид натрия или калия (см. § 197).
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например, известный из школьного курса лабораторный способ получения хлора действием диоксида марганца на соляную кислоту:
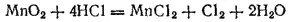
В ионно-молекулярной форме эта реакция выразится уравнением
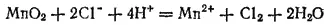
из которого видно, что здесь происходит окисление ионов Cl- в атомы хлора (образующие затем молекулы Cl 2) и восстановление марганца, входящего в состав MnO 2, до степени окисленности +2 (ионы Mn 2+). При помощи этой реакции хлор был впервые получен К. В. Шееле (Швеция) в 1774 г.
- 346 -
Аналогично можно получить хлор из соляной кислоты, действуя на нее такими окислителями, как PbO 2, KClO 3, KMnO 4.
Кислород в обычных условиях не взаимодействует с HCl в сколько-нибудь заметной степени. Но если пропускать HCl и O 2через трубку, нагретую до 400 содержащую кусочки пемзы, на которых распределен в качестве катализатора хлорид меди(II) CuCl 2, то происходит окисление хлороводорода кислородом
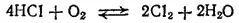
Интервал:
Закладка:








