Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Самый тяжелый галоген — астат — в природе практически не встречается. Его получают путем искусственно осуществляемых ядерных реакций. Наиболее долгоживущий изотоп астата 210At имеет период полураспада всего 8,3 ч.
- 341 -
Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада урана и тория.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление.
Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением в ряду F, Cl, Br, I, At радиуса атомов возрастает поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает возрастание температур плавления и кипения галогенов.
В ряду Cl 2-Br 2-I 2прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Э 2на атомы (табл. 23), Причины этого заключаются в следующем. С увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается все дальше от атомных ядер. Поэтому при переходе от хлора к брому и иоду притяжение ядер атомов галогена к области перекрывания электронных облаков уменьшается. Кроме того, в ряду Cl—Br—I возрастает число промежуточных электронных слоев, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания.
Уменьшение прочности связи в молекулах галогенов проявляется в падении их устойчивости к нагреванию: данные табл. 23 показывают, что при одной и той же температуре степень термической диссоциации молекул возрастает при переходе от Cl 2к Br 2и I 2. Однако из этих же данных следует, что фтор выпадает из общей закономерности: прочность связи между атомами в его молекуле меньше, а степень термической диссоциации молекул выше, чем у хлора. Такие аномальные свойства фтора можно объяснить отсутствием d-подуровня во внешнем электронном слое его атома. В молекуле хлора и других галогенов есть свободные d-орбитали, и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь. Это показано на следующей схеме:
Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора.
- 342 -
Раствор этот называется хлорной водой. При пропускании хлора в охлажденную до 0°C воду из раствора выделяются зеленовато-желтые кристаллы клатратного соединения Cl 2·8H 2O. Растворимость брома при 20°C составляет около 3,5 г, а растворимость иода всего 0,02 г на 100 г воды.
Фтор не может быть растворен в воде, так как энергично разлагает ее:
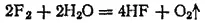
Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе, бензоле. Этим пользуются для извлечения брома и иода из водных растворов. Если, например, взболтать водный раствор иода с небольшим количеством сероуглерода (не смешивающегося с водой), то почти весь иод перейдет из воды в сероуглерод, окрашивая его в фиолетовый цвет.
119. Химические свойства галогенов.
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами. Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
2Na + Cl 2= 2NaCl
Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом взаимодействуют с металлами бром и иод. Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются. Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством. Следовательно, галогены — очень энергичные окислители.
Окислительные свойства галогенов проявляются также и при взаимодействии их со сложными веществами. Приведем несколько примеров.
1. При пропускании хлора через раствор хлорида железа (II) последний окисляется в хлорид железа (III), вследствие чего раствор из бледно-зеленого становится желтым:
2FeCl 2+Cl 2= 2FeCl 3
2. Если к желтоватому водному раствору иода добавить сероводородной воды (водный раствор H 2S ), то жидкость обесцвечивается и становится мутной от выделившейся серы:
- 343 -
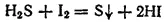
3. При действии водного раствора брома на раствор сульфита натрия Na 2SO 3происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород. Реакция протекает при участии молекул воды и выражается уравнением
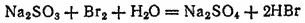
или в ионно-молекулярной форме:
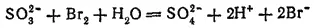
Химическая активность фтора исключительно высока. По образному выражению академика А. Е. Ферсмана, его можно назвать «всесъедающим». Щелочные металлы, свинец, железо загораются в атмосфере фтора при комнатной температуре. На некоторые металлы (Cu, Ni) фтор на холоду не действует, так как на их поверхности образуется защитный слой фторида. Однако при нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной.
Со многими неметаллами (водород, иод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени:

При нагревании с фтором соединяются хлор, криптон и ксенон, например:
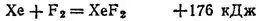
Непосредственно фтор не реагирует только с кислородом, азотом и углеродом (в виде алмаза).
Читать дальшеИнтервал:
Закладка:








