Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 335 -
Водород используют для охлаждения мощных генераторов электрического тока, а его изотопы находят применение в атомной энергетике (см. стр. 108).
Атомарный водород. При высокой температуре молекулы водорода диссоциируют на атомы:
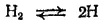
Осуществить эту реакцию можно, например, раскаляя током вольфрамовую проволочку в атмосфере сильно разреженного водорода. Реакция обратима, и чем выше температура, тем сильнее равновесие сдвинуто вправо. При 2000°C степень диссоциации (т. е. доля молекул, подвергшихся диссоциации) составляет только 0,1%, при 3000°C - 9%, при 4000°C - 62,5%, при 5000°C - 94,7% (все величины относятся к случаю, когда давление в системе равно нормальному атмосферному давлению).
Атомарный водород получается также при действии тихого электрического разряда - на молекулярный водород, находящийся под давлением около 70 Па. Образующиеся при этих условиях атомы водорода не сразу соединяются в молекулы, что дает возможность изучить их свойства.
При разложении водорода на атомы поглощается большое количество теплоты:

Отсюда понятно, что атомы водорода должны быть гораздо активнее его молекул. Чтобы молекулярный водород вступил в какую-либо реакцию, молекулы должны сперва распасться на атомы, для чего необходимо затратить большое количество энергии. При реакциях же атомарного водорода такой затраты энергии не требуется.
Действительно, атомарный водород уже при комнатной температуре восстанавливает многие оксиды металлов, непосредственно соединяется с серой, азотом и фосфором; с кислородом, он образует пероксид водорода.
117. Пероксид водорода H 2O 2
. Пероксид (перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью 1.45 г/см 3, затвердевающую при —0.48°C. Это очень непрочное вещество, способное разлагаться со взрывом на воду и кислород, причем выделяется большое количество теплоты:
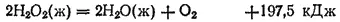
Водные растворы пероксида водорода более устойчивы; в прохладном месте они могут сохраняться довольно долго. Пергидроль — раствор, который поступает в продажу, — содержит 30% H 2O 2. В нем, а также в высококонцентрированных растворах пероксида водорода содержатся стабилизирующие добавки.
Разложение пероксида водорода ускоряется катализаторами. Если, например, в раствор пероксида водорода бросить немного диоксида марганца MnO 2, то происходит бурная реакция и выделяется кислород. К катализаторам, способствующим разложению пероксида водорода, принадлежат медь, железо, марганец, а также ионы этих металлов. Уже следы этих металлов могут вызвать распад H 2O 2.
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород.
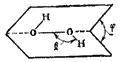
Рис. 108. Схема строения молекулы H 2O 2. Угол θ близок к 100°, угол φ — к 95°. Длины связей: O-O 0.149 нм.
Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода.
Пероксид водорода получается также при действии атомарного водорода на кислород.
В промышленности пероксид водорода получают в основном электрохимическими методами, например анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты H 2S 2O 8(см. § 132). Происходящие при этом процессы можно изобразить схемой:
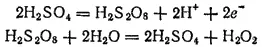
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой: Н—О—О—Н.
Молекулы H 2O 2обладают значительной полярностью (μ=2.13D), что является следствием их пространственной структуры (рис. 106).
В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода — очень слабая двухосновная кислота (K 1= 2.6·10 -12) в водном растворе он распадается, хотя и в незначительной степени, на ионы:
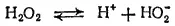
Диссоциация по второй ступени
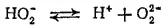
практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
С некоторыми основаниями пероксид водорода реагирует непосредственно, образуя соли.
- 337 -
Так, при действии пероксида водорода на водный раствор гидроксида бария выпадает осадок бариевой соли пероксида водорода:
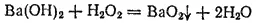
Соли пероксида водорода называются пероксидами или перекисями. Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов O 2 2-, электронное строение которых можно изобразить схемой:

Степень окисленности кислорода в пероксиде водорода равна —1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде (-2) и в молекулярном кислороде (0). Поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно-восстановительную двойственность. Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
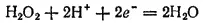
в которой H 2O 2выступает как окислитель, равен 1,776 В, в то время как стандартный потенциал электрохимической системы
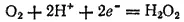
Интервал:
Закладка:








