Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
в которой пероксид водорода является восстановителем, равен 0,682 В. Иначе говоря, пероксид водорода может окислять вещества,ξ° которых не превышает 1,776 В, а восстанавливать только те, ξ° которых больше 0,682 В. По табл. 18 (на стр. 277) можно видеть, что в первую группу входит гораздо больше веществ.
В качестве примеров реакций, в которых H 2O 2служит окислителем, можно привести окисление нитрита калия
KNO 2+ H 2O 2= KNO 3+ H 2O
и выделение иода из иодида калия:
2KNI + H 2O 2= I 2+ 2KOH
Как пример восстановительной способности пероксида водорода укажем на реакции взаимодействия H 2O 2с оксидом серебра(I)
Ag 2O + H 2O 2= 2Ag + H 2O + O 2
а также с раствором перманганата калия в кислой среде:
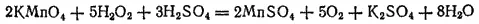
Если сложить уравнения, отвечающие восстановлению пероксида водорода и его окислению, то получится уравнение самоокисления-самовосстановления пероксида водорода:
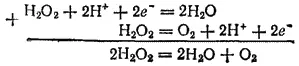
- 338 -
Это — уравнение процесса разложения пероксида водорода, о котором говорилось выше.
Применение пероксида водорода связано с его окислительной способностью и с безвредностью продукта его восстановления (H 2O). Его используют для отбелки тканей и мехов, применяют в медицине (3% раствор — дезинфицирующее средство), в пищевой промышленности (при консервировании пищевых продуктов), в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике.
Пероксид водорода применяют также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода. При промывании таких картин пероксидом водорода сульфид свинца окисляется в белый сульфат свинца:
PbS + H 2O 2= PbSO 4+ 4H 2O
Глава XII. ГАЛОГЕНЫ
Входящие в главную подгруппу VII группы элементы фтор (Fluorum), хлор (Chlorum), бром (Bromum), иод (Jodum) и астат (Astatine) называются галогенами. Это название, которое буквально означает «солерождающие», элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например хлорида натрия NaCl.
Во внешнем электронном слое атомы галогенов содержат семь электронов — два на s- и пять на р-орбиталях (ns 2np 5). Галогены обладают значительным сродством к электрону (табл. 23) — их атомы легко присоединяют электрон, образуя однозарядные отрицательные ионы, обладающие электронной структурой соответствующего благородного газа (ns 2np 6). Склонность к присоединению электронов характеризует галогены как типичные неметаллы. Аналогичное строение наружного электронного слоя обусловливает большое сходство галогенов друг с другом, проявляющееся как в их химических свойствах, так и в типах и свойствах образуемых ими соединений. Но, как показывает сопоставление свойств галогенов, между ними имеются и существенные различия.
В табл. 23 приведены некоторые свойства атомов галогенов и образуемых ими простых веществ.
- 339 -
Таблица 23. Свойства галогенов
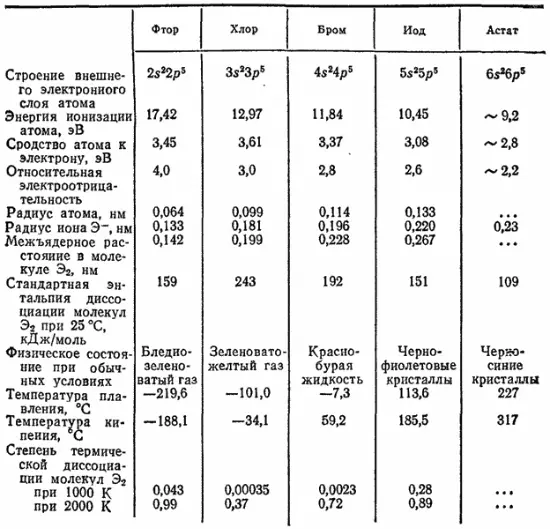
С повышением порядкового номера элементов в ряду F - At увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства и окислительная способность элементов.
В отличие от других галогенов, фтор в своих соединениях всегда находится в степени окисленности —1, поскольку среди всех элементов он обладает самой высокой электроотрицательностью. Остальные галогены проявляют различные степени окисленности от —1 до +7.
За исключением некоторых оксидов, которые будут рассмотрены ниже, все соединения галогенов соответствуют нечетным степеням окисленности. Такая закономерность обусловлена возможностью последовательного возбуждения спаренных электронов в атомах Cl, Br,I и At на d-подуровень, что приводит к увеличению числа электронов, принимающих участие в образовании ковалентных связей, до 3, 5 или 7 (см. схему на стр. 123).
- 340 -
118. Галогены в природе. Физические свойства галогенов.
Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот.
Фтор встречается в природе чаще всего в виде минерала плавикового шпата CaF 2, получившего это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна. Фтор содержится также в минералах криолите Na 3AlF 6и фторапатите Ca 5F(PO 4) 3.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьем для получения других соединений хлора. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl — таковы, например, в СССР озера Эльтон и Баскунчак. Хлорид натрия встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl·MgCl 2·6H 2O и сильвина KCl.
Хлор под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость. Сжиженный хлор обычно хранят и транспортируют в стальных баллонах или цистернах.
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов содержатся в морской воде, в воде некоторых озер и в подземных рассолах. В нашей стране содержание брома в подземных буровых водах, имеющих промышленное значение, составляет от 170 до 700 мг/л.
Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьем для получения иода. Значительные количества иода (от 10 до 50 мг/л) содержатся в подземных буровых водах (от 10 до 50 мг/л) встречается также в виде солей калия — иодата KIO 3и перйодата KIO 4, сопутствующих залежам нитрата натрия (селитры) в Чили и Боливии.
Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пары фиолетового цвета, при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Читать дальшеИнтервал:
Закладка:








