Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Прочность реальных материалов из-за дефектов их кристаллической структуры значительно ниже прочности идеальных монокристаллов. Если диспергировать материал до частиц, размеры которых соизмеримы с расстояниями между дефектами структуры, то прочность таких высокодисперсных частиц будет близка к прочности идеальных твердых тел. Отсюда возникла идея о повышении прочности материалов путем их измельчения с последующим свариванием, спеканием уплотненных дисперсных порошков. На основе этой идеи разработано производство новых материалов и изделий из них — порошковая металлургия, металлокерамика (см. § 229).
Широкие возможности создания новых материалов открываются на основе композиций из неорганических веществ и полимеров органических соединений. Примером их являются резины, состоящие из вулканизованных каучуков и сажи, масса которой достигает 50% массы резины.
- 330 -
В зависимости от соотношения компонентов и от распределения серы и сажи в каучуке можно получать резины с разнообразными свойствами. На этом примере полезно подчеркнуть различие понятий о веществах и материалах. Каучук, сажа, сера — это вещества, из которых создается материал определенной структуры — резина.
Глава XI. ВОДОРОД
Водород (Hydrogenium) был открыт в первой половине XVI века немецким врачом и естествоиспытателем Парацельсом. В 1776 г. Г. Кавендиш (Англия) установил его свойства и указал отличия от других газов. Лавуазье первый получил водород из воды и доказал, что вода есть химическое соединение водорода с кислородом (1783 г.).
Водород имеет три изотопа: протий 1H , дейтерий 2H или D и тритий 3H или Т. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий — радиоактивен (период полураспада 12,5 лет). В природных соединениях дейтерий и протий в среднем содержатся в отношении 1:6800 (по числу атомов). Тритий находится в природе в ничтожно малых количествах.
Ядро атома водорода 1H содержит один протон. Ядра дейтерия и трития включают кроме протона соответственно один и два нейтрона.
Молекула водорода состоит из двух атомов. Приведем некоторые свойства, характеризующие атом и молекулу водорода:
Энергия ионизации атома, эВ 13,60
Сродство атома к электрону, эВ 0,75
Относительная электроотрицательность 2,1
Радиус атома, нм 0,046
Межъядерное расстояние в молекуле, нм 0,0741
Стандартная эитальпия диссоциации молекул при 25°C, кДж/моль 436,1 115.
Водород в природе. Получение водорода.
Водород в свободном состоянии встречается на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти. Но в виде соединений водород весьма распространен. Это видно уже из того, что он составляет девятую часть массы воды. Водород входит в состав всех растительных и животных организмов, нефти, каменного и бурого углей, природных газов и ряда минералов. На долю водорода из всей массы земной коры, считая воду и воздух, приходится около 1%. Однако при пересчете на проценты от общего числа атомов содержание водорода в земной коре равно 17%.
- 331 -
Водород — самый распространенный элемент космоса. На его долю приходится около половины массы Солнца и большинства других звезд. Он содержится в газовых туманностях, в межзвездном газе, входит в состав звезд. В недрах звезд происходит превращение ядер атомов водорода в ядра атомов гелия. Этот процесс протекает с выделением энергии, для многих звезд, в том числе для Солнца, он служит главным источником энергии. Скорость процесса, т. е. количество ядер водорода, превращающихся в ядра гелия в одном кубическом метре за одну секунду, мала. Поэтому и количество энергии, выделяющейся за единицу времени в единице объема, мало. Однако, вследствие огромности массы Солнца, общее количество энергии, генерируемой и излучаемой Солнцем, очень велико. Оно соответствует уменьшению массы Солнца приблизительно на 4 млн. т в секунду.
В промышленности водород получают главным образом из природного газа. Этот газ, состоящий в основном из метана, смешивают с водяным паром и с кислородом. При нагревании смеси газов до 800-900°C в присутствии катализатора происходит реакция, которую схематически можно изобразить уравнением:
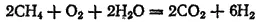
Полученную смесь газов разделяют. Водород очищают и либо используют на месте получения, либо транспортируют в стальные баллонах под повышенным давлением.
Важным промышленным способом получения водорода служит также его выделение из коксового газа или из газов переработки нефти. Оно осуществляется глубоким охлаждением, при котором все газы, кроме водорода сжижаются.
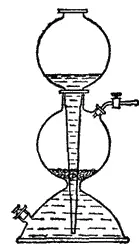
В лабораториях водород получают большей частью электролизом водных растворов NaOH или KOH. Концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости (25% для NaOH и 34% для KOH). Электроды обычно изготовляют из листового никеля. Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и от следов кислорода. Из других лабораторных методой наиболее распространен метод выделения водорода из растворов серной или соляной кислот действием на них цинка. Реакцию обычно проводят в аппарате Киппа (рис. 105).
116. Свойства и применение водорода.
Водород — бесцветный газ, не имеющий запаха. При температуре ниже -240.8°C (критическая температура водорода) он под давлением сжижается температура кипения жидкого водорода -252.8°C (при нормальном атмосферном давлении).
Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при -259.2°C.
Водород — самый легкий из всех газов, он в 14,5 раза легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, палладии, платине, растворяется в значительных количествах.
С растворимостью водорода в металлах связана его способность диффундировать через металлы. Кроме того, будучи самым легким газом, водород обладает наибольшей скоростью диффузии: его молекулы быстрее молекул всех других газов распространяются в среде другого вещества и проходят через разного рода перегородки. Особенно велика его способность к диффузии при повышенном давлении и высоких температурах. Поэтому работа с водородом в таких условиях сопряжена со значительными трудностями.
Читать дальшеИнтервал:
Закладка:








