Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Потенциальная энергия взаимодействия (U) между коллоидными частицами представляет собой алгебраическую сумму потенциальной энергии электростатического отталкивания (U э) и потенциальной энергии дисперсионного притяжения (U д) между ними:
U = U д+ U э
Если U э> U д(по абсолютной величине), то отталкивание преобладает над притяжением и дисперсная система устойчива.
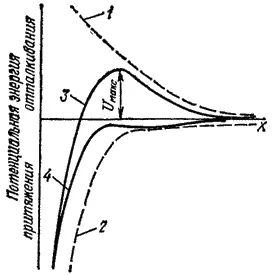
Рис. 103. Потенциальная энергия взаимодействия между двумя одинаково заряженными частицами: 1 — электрическое отталкивание (U э) 2 - дисперсионное притяжение (U д); 3 - результирующая энергия взаимодействия (U); 4 - то же, но при более крутом падении кривой 1; х - расстояние между частицами; U макс- потенциальный барьер взаимодействия дисперсных частиц.
- 322 -
Если Если U э< U д, то происходит слипание сталкивающихся при броуновском движении коллоидных частиц в более крупные агрегаты и седиментация последних. Коллоидный раствор коагулирует, т. е. разделяется на коагулят (осадок) и дисперсионную среду.
В этом состоит сущность теории электрической стабилизации и коагуляции дисперсных систем, развитой впервые Б. В. Дерягиным (1937), а затем Л. Д. Ландау и голландскими учеными Фервеем и Овербеком (1948 г.); по первым буквам фамилий авторов ее называют теорией ДЛФО.
На рис. 103 приведены зависимости величин U ди U эот расстояния между коллоидными частицами. При этом, как принято в физике, потенциальной энергии притяжения приписывается знак минус, а отталкивания — знак плюс. Как видно, результирующая энергия взаимодействия (кривая 3 на рис. 103) приводит к притяжению (U<0) на очень малых и отталкиванию (U>0) на больших расстояниях между частицами. Решающее значение для устойчивости дисперсных систем имеет величина потенциального барьера отталкивания U макс, которая, в свою очередь, зависит от хода кривых U ди U э. При больших значениях этого барьера коллоидная система устойчива. Слипание коллоидных частиц возможно лишь при достаточном их сближении. Это требует преодоления потенциального барьера отталкивания. При некоторых небольших положительных значениях U макс(кривая 3) преодолеть его могут лишь немногие коллоидные частицы с достаточно большой кинетической энергией. Это соответствует стадии медленной коагуляции, когда только небольшая часть соударений коллоидных частиц приводит к их слипанию. При медленной коагуляции со временем происходит некоторое уменьшение общего числа коллоидных частиц в результате образования агрегатов из первичных частиц, но коагулят не выпадает. Подобную коагуляций, не сопровождающуюся видимым изменением коллоидного раствора, называют скрытой коагуляцией.
- 323 -
При дальнейшем уменьшении потенциального барьера скорость коагуляции, характеризуемая изменением числа частиц в единицу времени, возрастает. Наконец, если потенциальный барьер переходит из области отталкивания в область притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция, когда каждое соударение коллоидных частиц приводит к их слипанию; в коллоидном растворе образуется осадок — коагулят, происходит явная коагуляция.
Потенциальный барьер отталкивания (U макс) возникает в результате суммирования сил отталкивания и притяжения, действующих между коллоидными частицами. Поэтому все факторы, влияющие на ход кривых 1 и 2 (рис. 103), приводят к изменению как величины U макс, так и положения максимума (т. е. расстояния X, соответствующего U макс).
Значительное уменьшение U макспроисходит в результате изменения потенциальной энергии электростатического отталкивания (т. е. хода кривой 1), вызванного добавлением электролитов к коллоидному раствору. С увеличением концентрации любого электролита происходит перестройка двойного электрического слоя, окружающего коллоидные частицы: все большая часть противо-ионов вытесняется из диффузной в адсорбционную часть двойного Электрического слоя. Толщина диффузной части двойного электрического слоя (слой 4 на рис. 100), а вместе с ней и всего двойного электрического слоя (слой 2 на рис. 100) уменьшается. Поэтому кривая потенциальной энергии электростатического отталкивания снижается более круто, чем показанная на рис. 103 кривая 1. В результате этого потенциальный барьер отталкивания (U макс) уменьшается и смещается в сторону меньшего расстояния между коллоидными частицами. Когда двойной электрический слой сжимается до толщины адсорбционного слоя (слой 8 на рис. 100), то вся кривая взаимодействия дисперсных частиц оказывается в области притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция. Такое изменение устойчивости коллоидного раствора происходит при добавлении любого электролита.
Коагулирующее действие электролитов характеризуют порогом коагуляции, т. е. наименьшей концентрацией электролита, вызывающей коагуляцию. В зависимости от природы электролита и коллоидного раствора порог коагуляции изменяется в пределах от 10 -5до 0,1 моль в литре золя. Наиболее существенное влияние на порог коагуляции оказывает заряд коагулирующего иона электролита, т. е. иона, заряд которого противоположен по знаку заряду коллоидной частицы.
Многозарядные противоионы электролита имеют повышенную адсорбционную способность по сравнению с однозарядными и проникают в адсорбционную часть двойного электрического слоя в больших количествах. При этом порог коагуляции уменьшается не пропорционально заряду противоиона, а значительно быстрее.
- 324 -
Блестящим подтверждением теории ДЛФО явился расчет Б. В. Дерягиным и Л. Д. Ландау (1941 г.) соотношения значений порогов коагуляции вызываемой электролитами, содержащими ионы с разной величиной заряда. Оказалось, что порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона. Следовательно, значения порогов коагуляции для одно-, двух-, трех- и четырехзарядных ионов должны относиться, как
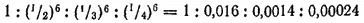
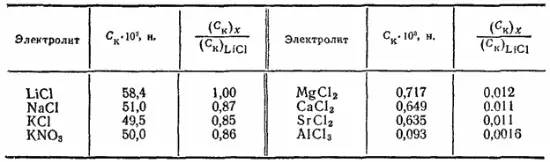
что близко к соотношениям концентраций электролитов, которые наблюдались при коагуляции разнообразных гидрозолей. Сказанное иллюстрируют данные табл. 22, где приведены эквивалентные концентрации электролитов C к, вызывающие коагуляцию гидрозоля оксида мышьяка(III).
Таблица 22. Пороги коагуляции (C к) отрицательно заряженного золя As 2O 3электролитами
Молекулярно-адсорбционная стабилизация дисперсных систем играет большую роль в устойчивости дисперсий как в водной, так и в неводных средах. Дисперсные системы в неводных средах в принципе менее устойчивы, чем в водной среде. В неполярной и не содержащей воды дисперсионной среде частицы дисперсной фазы лишены электрического заряда. Электрический фактор стабилизации отсутствует. Между дисперсными частицами действуют только силы взаимного притяжения. Ослабление этих сил, приводящее к стабилизации дисперсных систем, может происходить в результате образования вокруг коллоидных частиц адсорбционных слоев из молекул дисперсионной среды и растворенных в ней веществ. Такие слои ослабляют взаимное притяжение частиц дисперсной фазы и создают механическое препятствие их сближению.
Читать дальшеИнтервал:
Закладка:








