Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
При относительном перемещении фаз, из-за гидратации твердой поверхности и ионов граница скольжения проходит на некотором расстоянии от твердой поверхности. В результате этого двойной электрический слой подразделяется на плотную (адсорбционную) и диффузную части (рис. 100).
Адсорбционная (плотная) часть двойного электрического слоя состоит из потенциалопределяющих ионов и части противоионов. Диффузная часть двойного электрического слоя образована остальными противоионами. Скорость перемещения фаз в электрическом поле определяется величиной потенциала на поверхности скольжения, который поэтому назван электроникетическим потенциалом и кратко обозначается как ζ -потенциал (дзета-потенциал). Этому потенциалу приписывают знак заряда твердой поверхности.
В постоянном внешнем электрическом поле коллоидная частица перемещается к электроду, знак заряда которого противоположен знаку заряда поверхности коллоидной частицы (рис. 101, а). Электроосмотический перенос жидкости направлен к электроду, имеющему тот же знак, что и поверхность капилляра К (рис. 101,б). В этом случае в электрическом поле подвижны гидратированные противоионы, которые увлекают прилегающие к ним слои воды.
Изменение структуры двойного электрического слоя возможно в нескольких направлениях. При очень малых концентрациях электролитов, по мере заполнения активных центров поверхности потенциалопределяющими ионами, будет происходить увеличение ε-потенциала. Противоионы с высокой адсорбционной способностью (например, многозарядные ионы) могут проникнуть в адсорбционный слой в количествах, сверхэквивалентных первоначальным потенциалопределяющим ионам, вызывая изменение знака заряда поверхности с соответствующей перестройкой всего двойного электрического слоя (перезарядка коллоидов).
Диффузная часть двойного электрического слоя наиболее лабильна и изменчива. Противоионы обмениваются на другие ионы того же знака.
- 320 -
Повышение концентрации раствора приводит к «вытеснению» противоионов из диффузной в плотную часть двойного электрического слоя. Толщина двойного электрического слоя и величина ζ-потенциала уменьшаются. При некоторой концентрации раствора (примерно 0.1 н.) все противоионы оказываются вытесненными в адсорбционный слой и ζ-потенциал становится равным нулю. В этом случае изменение межфазового потенциала от его максимального значения на поверхности твердой фазы до нулевого целиком происходит в пределах адсорбционного слоя. Такое состояние коллоидной мицеллы называют изоэлектрическим состоянием.
Из сказанного следует, что электрокинетические явления проявляются в разбавленных растворах электролитов (<0,1 н.). Электрокинетический потенциал имеет порядок 0,001-0,1 В. Несмотря на небольшую величину, ζ-потенциал играет существенную роль в устойчивости коллоиднодисперсных систем (см. § 113).
Электрокинетические явления находят практическое применение. Так, с помощью электрофореза проводят формование различных изделий из тонких взвесей с последующим их спеканием. Метод электрофореза широко применяют для разделения, выделения и исследования биоколлоидов, особенно белков. Простой его вариант, называемый электрофорезом на бумаге, состоит в том, что нанесенное на полоску бумаги пятно исследуемой смеси белков разделяется на компоненты по величине их заряда, а следовательно, и скорости движения в поле постоянного электрического тока. Этим методом исследуют качественный и количественный состав белков крови и других биологических жидкостей.
Путем электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических и других сооружений.
Возникновение электрических полей при течении грунтовых вод помогает в геологической разведке полезных ископаемых и водных источников.
113. Устойчивость и коагуляция дисперсных систем.
Как указывалось в § 106, качественная особенность дисперсных систем состоит в их агрегативной неустойчивости.
Предотвращение агрегации первичных дисперсных частиц возможно в результате действия трех факторов устойчивости дисперсных систем: 1) кинетического, 2) электрического и 3) структурно-механического.
Необходимым условием слипания двух частиц дисперсной фазы является их сближение, достаточное для проявления сил притяжения. Если частота столкновений коллоидных частиц мала, то дисперсная система может быть устойчивой (кинетический фактор устойчивости). Это может иметь место при очень малой концентрации дисперсных частиц (например, в некоторых аэрозолях) или при очень большой вязкости дисперсионной среды (например, в дисперсных системах типа T 1-T 2).
- 321 -
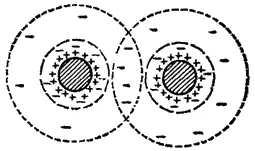
Рис. 102. Схема перекрывания ионных атмосфер двух коллоидных частиц.
Большинство устойчивых дисперсных систем кроме дисперсной фазы и дисперсионной среды содержат еще 3-й компонент, являющийся стабилизатором дисперсности. Стабилизатором могут быть как ионы, так и молекулы, в связи с чем различают два механизма стабилизации дисперсных систем: электрический и молекулярно-адсорбционный (стр. 324),
Электрическая стабилизация дисперсных систем связана с возникновением двойного электрического слоя на границе раздела фаз. Такая стабилизация имеет основное значение для получения устойчивых лиозолей и суспензий в полярной среде, например в воде. В любом гидролизе все коллоидные частицы имеют одинаковый знак заряда. Однако коллоидная мицелла в целом электронейтральна в результате образования двойного электрического слоя. Поэтому электростатическое отталкивание между коллоидными частицами (электрический фактор устойчивости) возникает только при достаточном их сближении, когда происходит перекрывание их ионных атмосфер (рис. 102). Потенциальная энергия электростатического отталкивания тем больше, чем больше перекрывание диффузных частей двойного электрического слоя коллоидных частиц, т. е. чем меньше расстояние (x) между ними и чем больше толщина двойного электрического слоя.
Кроме электростатического отталкивания между коллоидными частицами, как и между молекулами любого вещества, действуют межмолекулярные силы притяжения, среди которых наибольшую роль играют дисперсионные силы. Действующие между отдельными молекулами дисперсионные силы быстро убывают с увеличением расстояния между ними. Но взаимодействие коллоидных частиц обусловлено суммированием дисперсионных сил притяжения между всеми молекулами, находящимися на поверхности контакта коллоидных частиц. Поэтому силы притяжения между коллоидными частицами убывают медленнее и проявляются на больших расстояниях, чем в случае отдельных молекул.
Читать дальшеИнтервал:
Закладка:








